题目内容
某二元酸(化学式用H2B表示)在水中的电离方程式是:
H2B?H++HB- NB-?H++B2- 回答下列问题:
(1)在0.1mol?L-1的Na2B溶液中,下列粒子浓度关系式正确的是 .
A.c(Na+)+c(OH+ )=c(H+)+c(HB-)
B.c(Na+)+c(H+ )=c(OH- )+c(HB-)+2c(B2- )
C.c(Na+)=2c(B2- )+2c(HB- )
(2)已知0.1mol?L-1NaHB溶液的pH=2,则0.1mol?L-1H2B溶液中氢离子的物质的量浓度可能是 0.11mol?L-1(填“大于”、“等于”、“小于”或“无法确定”);
(3)已知难溶物CaB在水中存在溶解平衡:CaB(s)?Ca2+(aq)+B2-(aq),测得25℃时,CaB的Ksp为2.0×10-11,常温下将10gCaB固体投入100ml0.1mol/LCaCl2溶液中,充分搅拌后仍有固体剩余,则溶液中c(B2-)= mol/L.
H2B?H++HB- NB-?H++B2- 回答下列问题:
(1)在0.1mol?L-1的Na2B溶液中,下列粒子浓度关系式正确的是
A.c(Na+)+c(OH+ )=c(H+)+c(HB-)
B.c(Na+)+c(H+ )=c(OH- )+c(HB-)+2c(B2- )
C.c(Na+)=2c(B2- )+2c(HB- )
(2)已知0.1mol?L-1NaHB溶液的pH=2,则0.1mol?L-1H2B溶液中氢离子的物质的量浓度可能是
(3)已知难溶物CaB在水中存在溶解平衡:CaB(s)?Ca2+(aq)+B2-(aq),测得25℃时,CaB的Ksp为2.0×10-11,常温下将10gCaB固体投入100ml0.1mol/LCaCl2溶液中,充分搅拌后仍有固体剩余,则溶液中c(B2-)=
考点:离子浓度大小的比较,盐类水解的应用,难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:(1)根据该二元酸的电离方程式知,B2-能够发生两步水解,结合电荷守恒和物料守恒分析解答;
(2)若0.1mol?L-1NaHB溶液的pH=2,说明溶液中c(H+)=0.01mol/L,则HB-的电离度是10%,H2B第一步不完全电离,第二步部分电离,且含有相同的离子能抑制弱根离子的电离;
(3)根据Ksp=c(Ca2+)×c(B2+)以及钙离子的浓度计算.
(2)若0.1mol?L-1NaHB溶液的pH=2,说明溶液中c(H+)=0.01mol/L,则HB-的电离度是10%,H2B第一步不完全电离,第二步部分电离,且含有相同的离子能抑制弱根离子的电离;
(3)根据Ksp=c(Ca2+)×c(B2+)以及钙离子的浓度计算.
解答:
解:(1)A.根据电荷守恒可得:c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-),故A错误;
B.溶液中满足电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-),故B正确;
C.根据物料守恒可得:c(Na+)=2c(B2-)+2c(HB-)+2c(H2B),故C正确;
故答案为:B;
(2)若0.1mol?L-1NaHB溶液的pH=2,说明溶液中c(H+)=0.01mol/L,则HB-的电离度是10%,H2B第一步不能完全电离,第二步部分电离,由于H2B第一步电离产生的H+抑制了HB-的电离,故H2B(0.1 mol/L)的c(H+)小于0.11 mol/L,
故答案为:小于;
(3)已知溶液中c(Ca2+)=0.1mol/L,Ksp=c(Ca2+)×c(B2+)=2.0×10-11,则c(B2-)=
mol/L=2.0×10-10mol/L,
故答案为:2.0×10-10.
B.溶液中满足电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-),故B正确;
C.根据物料守恒可得:c(Na+)=2c(B2-)+2c(HB-)+2c(H2B),故C正确;
故答案为:B;
(2)若0.1mol?L-1NaHB溶液的pH=2,说明溶液中c(H+)=0.01mol/L,则HB-的电离度是10%,H2B第一步不能完全电离,第二步部分电离,由于H2B第一步电离产生的H+抑制了HB-的电离,故H2B(0.1 mol/L)的c(H+)小于0.11 mol/L,
故答案为:小于;
(3)已知溶液中c(Ca2+)=0.1mol/L,Ksp=c(Ca2+)×c(B2+)=2.0×10-11,则c(B2-)=
| 2×10-11 |
| 0.1 |
故答案为:2.0×10-10.
点评:本题考查了盐溶液酸碱性的判断、溶液中离子浓度的关系、难溶物溶解平衡及其计算,题目难度中等,注意掌握判断溶液中离子浓度大小的常用方法,明确电荷守恒、物料守恒的含义及有关难溶物溶度积计算方法.

练习册系列答案
相关题目
在恒温恒容的某密闭容器中,建立下列化学平衡:C(s)+H2O(g)
CO(g)+H2(g),下列叙述中不能说明上述可逆反应已达到化学平衡状态的是( )
| 高温 |
| A、体系的压强不再发生变化 |
| B、生成nmolCO的同时生成n molH2 |
| C、v正(CO)=v逆(H2O) |
| D、1molH-H键断裂的同时2molH-O键断裂 |
把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液等体积混合后呈酸性,则混合溶液中粒子浓度关系正确的是( )
| A、c(CH3COO-)>c(Na+) |
| B、c(CH3COOH)>c(CH3COO-) |
| C、2c(H+)=c(CH3COO-)-c(CH3COOH) |
| D、c(CH3COOH)+c(CH3COO-)=0.02mol/L |
下列过程需要通电后才可以发生或进行的是( )
①电离 ②电泳 ③电解 ④电镀 ⑤电化学腐蚀.
①电离 ②电泳 ③电解 ④电镀 ⑤电化学腐蚀.
| A、①② | B、②③④ |
| C、②③④⑤ | D、全部 |
在室温下pH=13的强碱与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比为( )
| A、9:1 | B、1:11 |
| C、1:9 | D、11:1 |
下列有关pH或c(H+)变化的判断中,正确的是( )
| A、其他条件不变,温度的升高,纯水的pH不变 |
| B、其他条件不变,加水稀释后,碳酸钠溶液的c(H+)减小 |
| C、其他条件不变,温度的升高,碳酸溶液的c(H+)基本不变 |
| D、其他条件不变,常温pH=5的盐酸稀释1000倍后,溶液的pH变为8 |
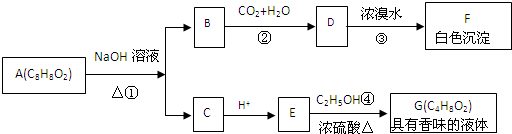
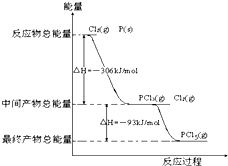 红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据),根据图回答下列问题:
红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据),根据图回答下列问题: