题目内容
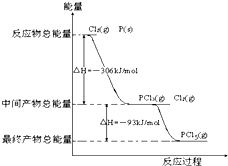 红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据),根据图回答下列问题:
红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据),根据图回答下列问题:(1)PCl5分解生成PCl3和Cl2的热化学方程式
(2)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5,原因是
(3)P和Cl2分两步反应生成1molPCl5的△H3=
考点:热化学方程式,化学平衡的影响因素
专题:化学反应中的能量变化,化学平衡专题
分析:(1)根据反应物的总能量、中间产物的总能量以及最终产物的总能量,结合化学方程式以及热化学方程式的书写方法解答;
依据分解率=
×100%计算;
吸热反应,升高温度平衡向正向移动;
(2)根据化学平衡移动原理分析;
(3)根据盖斯定律计算解答.
依据分解率=
| 分解量 |
| 起始量 |
吸热反应,升高温度平衡向正向移动;
(2)根据化学平衡移动原理分析;
(3)根据盖斯定律计算解答.
解答:
解:(1)由图象可知,1molPCl5分解成PCl3和Cl2需要吸收93kJ的能量,则反应的热化学方程式为PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ?mol-1,
在密闭容器中加入0.8molPCl5,反应达到平衡时还剩余0.6molPCl5,分解的PCl5为0.2mol,分解率=
×100%=25%;
PCl5(g)═PCl3(g)+Cl2(g);△H=+93kJ?mol-1,为吸热反应,升高温度平衡向正向移动,所以分解率α2大于α1;
故答案为:PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ?mol-1;25%;大于;
(2)Cl2(g)+PCl3(g)=PCl5(g),是放热反应,降温平衡向放热反应方向移动,降温有利于PCl5(g)的生成,
故答案为:两步反应均为放热反应,降低温度有利于提高产率,防止产物分解;
(3)根据盖斯定律,P和Cl2分两步反应和一步反应生成PCl5的△H应该是相等的,P和Cl2分两步反应生成1 molPCl5的热化学方程式:
①P(s)+
Cl2(g)=PCl3(g);△H1=-306 kJ/mol,
②Cl2(g)+PCl3(g)=PCl5(g);△H2=-93 kJ/mol;
依据盖斯定律可知:①+②得:P(s)+
Cl2(g)=PCl5(g),△H=-306 kJ/mol+(-93 kJ/mol)=-399 kJ/mol,
故答案为:-399kJ?mol-1.
在密闭容器中加入0.8molPCl5,反应达到平衡时还剩余0.6molPCl5,分解的PCl5为0.2mol,分解率=
| 0.2mol |
| 0.8mol |
PCl5(g)═PCl3(g)+Cl2(g);△H=+93kJ?mol-1,为吸热反应,升高温度平衡向正向移动,所以分解率α2大于α1;
故答案为:PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ?mol-1;25%;大于;
(2)Cl2(g)+PCl3(g)=PCl5(g),是放热反应,降温平衡向放热反应方向移动,降温有利于PCl5(g)的生成,
故答案为:两步反应均为放热反应,降低温度有利于提高产率,防止产物分解;
(3)根据盖斯定律,P和Cl2分两步反应和一步反应生成PCl5的△H应该是相等的,P和Cl2分两步反应生成1 molPCl5的热化学方程式:
①P(s)+
| 3 |
| 2 |
②Cl2(g)+PCl3(g)=PCl5(g);△H2=-93 kJ/mol;
依据盖斯定律可知:①+②得:P(s)+
| 5 |
| 2 |
故答案为:-399kJ?mol-1.
点评:本题考查热化学方程式的书写、化学平衡计算、外界条件对化学平衡移动的影响及反应热的计算等,题目综合性较强,难度中等,明确热化学方程式书写方法和盖斯定律求反应热的方法是解题关键,侧重考查学生分析问题、解决问题的能力.

练习册系列答案
相关题目
绿原酸的结构简式如图,下列有关绿原酸的说法正确的是( )


| A、分子式为C16H15O9 |
| B、不能与NaHCO3溶液反应 |
| C、能发生取代反应和消去反应 |
| D、1 mol绿原酸最多与可8mol NaOH反应 |
下列叙述正确的是( )
| A、盐酸中滴加氨水至中性,溶质为氯化铵 |
| B、稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小 |
| C、饱和石灰水中加入少量CaO,恢复至原温后溶液的pH值不变 |
| D、向沸水中滴加适量饱和FeCl3溶液,可制得红褐色带电的胶体 |
对于某些离子的检验及结论一定正确的是( )
| A、加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,有CO32-或HCO3-中的一种或两种 |
| B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| C、加入硝酸酸化的硝酸银溶液有白色沉淀生成,则溶液中一定含有Cl- |
| D、加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ba2+ |
恒温、恒压下,1molA和nmolB在一个容积可变的密闭容器中发生如下反应:A(g)+2B(g)?2C(g),一段时间后达到平衡,生成amolC,则下列说法中正确的是( )
| A、当n=2时,物质A、B的转化率之比为1:2 | ||
B、起始时刻和达到平衡后容器中的压强比为(1+n):(1+n-
| ||
| C、当v(A)正=2v(C)逆时,可断定反应达到平衡 | ||
| D、若起始时放入3molA和3n molB,则达到平衡时生成3a mol的C |
 (Ⅰ)乙苯的结构简式可以表示为
(Ⅰ)乙苯的结构简式可以表示为 ,下图是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为“doggycene”.
,下图是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为“doggycene”.



