题目内容
X、Y、Z、W、P为短周期的主族元素,其原子序数依次增大.Y、Z、W、P位于同一周期.X元素形成的单质是自然界中含量最多的气体,1mol Y的单质分别与足量盐酸和氢氧化钠溶液反应生成的气体在标况下均为33.6L.W的原子最外层电子数与核外电子总数之比为3:8,X的原子序数是Z的原子序数的一半.
(1)Y在周期表中的位置是 ;X的氢化物与P的氢化物接近时的现象是 .
(2)W与P可形成原子个数比为1:2的化合物,其电子式为 .
(3)Y与P形成的化合物溶液显 性;用离子反应方程式表示显这种性质的原因 .
(4)Z、W、P三种元素的气态氢化物稳定性由高到低的顺序是 (填化学式).
(5)X的三氟化物是微电子工业中优良的等离子刻蚀气体,但在潮湿的环境中能与水发生反应生成无色气体,遇空气变为红棕色.写出此三氟化物与水反应的化学反应方程式 ,若0.6molX的三氟化物完全与 水反应,则转移的电子总数约为 个.
(1)Y在周期表中的位置是
(2)W与P可形成原子个数比为1:2的化合物,其电子式为
(3)Y与P形成的化合物溶液显
(4)Z、W、P三种元素的气态氢化物稳定性由高到低的顺序是
(5)X的三氟化物是微电子工业中优良的等离子刻蚀气体,但在潮湿的环境中能与水发生反应生成无色气体,遇空气变为红棕色.写出此三氟化物与水反应的化学反应方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W、P为短周期的主族元素,其原子序数依次增大,Y、Z、W、P位于同一周期,X元素形成的单质是自然界中含量最多的气体,则X为N元素;
1mol Y的单质分别与足量盐酸和氢氧化钠溶液反应生成的气体在标况下均为33.6L,则Y为Al元素;
W的原子最外层电子数与核外电子总数之比为3:8,且W位于第三周期,则W为最外层电子数为S元素;
X的原子序数是Z的原子序数的一半,则Z为Si元素;
P元素为短周期主族元素且原子序数大于W,则P为Cl元素,
(1)Y为Al元素,Al在周期表中的位置是第三周期第IIIA族;X的氢化物是氨气,P的氯化氢是HCl,二者相互接近有白烟生成;
(2)W是S元素、P是Cl元素,W与P可形成原子个数比为1:2的化合物为SCl2,每个Cl原子和S原子形成一对共用电子对;
(3)Y为Al元素、P为Cl元素,Y与P形成的化合物为为AlCl3,氯化铝为强酸弱碱盐,铝离子水解而使溶液呈酸性;
(4)Z为Si元素、W为S元素、P为Cl元素,元素的非金属性越强,其气态氢化物越稳定;
(5)X是N元素,X的三氟化物与水发生反应生成NO,根据原子守恒知,还生成硝酸、HF;根据三氟化氮与转移电子之间的关系式计算.
1mol Y的单质分别与足量盐酸和氢氧化钠溶液反应生成的气体在标况下均为33.6L,则Y为Al元素;
W的原子最外层电子数与核外电子总数之比为3:8,且W位于第三周期,则W为最外层电子数为S元素;
X的原子序数是Z的原子序数的一半,则Z为Si元素;
P元素为短周期主族元素且原子序数大于W,则P为Cl元素,
(1)Y为Al元素,Al在周期表中的位置是第三周期第IIIA族;X的氢化物是氨气,P的氯化氢是HCl,二者相互接近有白烟生成;
(2)W是S元素、P是Cl元素,W与P可形成原子个数比为1:2的化合物为SCl2,每个Cl原子和S原子形成一对共用电子对;
(3)Y为Al元素、P为Cl元素,Y与P形成的化合物为为AlCl3,氯化铝为强酸弱碱盐,铝离子水解而使溶液呈酸性;
(4)Z为Si元素、W为S元素、P为Cl元素,元素的非金属性越强,其气态氢化物越稳定;
(5)X是N元素,X的三氟化物与水发生反应生成NO,根据原子守恒知,还生成硝酸、HF;根据三氟化氮与转移电子之间的关系式计算.
解答:
解:X、Y、Z、W、P为短周期的主族元素,其原子序数依次增大,Y、Z、W、P位于同一周期,X元素形成的单质是自然界中含量最多的气体,则X为N元素;
1mol Y的单质分别与足量盐酸和氢氧化钠溶液反应生成的气体在标况下均为33.6L,则Y为Al元素;
W的原子最外层电子数与核外电子总数之比为3:8,且W位于第三周期,则W为最外层电子数为S元素;
X的原子序数是Z的原子序数的一半,则Z为Si元素;
P元素为短周期主族元素且原子序数大于W,则P为Cl元素,
(1)Y为Al元素,Al在周期表中的位置是第三周期第IIIA族;X的氢化物是氨气,P的氯化氢是HCl,二者相互接近有白烟生成,其成分为氯化铵固体,故答案为:第三周期第IIIA族;有白烟生成;
(2)W是S元素、P是Cl元素,W与P可形成原子个数比为1:2的化合物为SCl2,每个Cl原子和S原子形成一对共用电子对,其电子式为 ,故答案为:
,故答案为: ;
;
(3)Y为Al元素、P为Cl元素,Y与P形成的化合物为为AlCl3,氯化铝为强酸弱碱盐,铝离子水解而使溶液呈酸性,水解方程式为Al3++3H2O?Al(OH)3+3H+,故答案为:酸;Al3++3H2O?Al(OH)3+3H+;
(4)Z为Si元素、W为S元素、P为Cl元素,非金属性Cl>S>Si,所以氢化物的稳定性HCl>H2S>SiH4,故答案为:HCl>H2S>SiH4;
(5)NCl3在潮湿的环境中能与水发生反应生成无色气体,遇空气变为红棕色,说明生成NO,同时还生成硝酸和氢氟酸,该反应的化学方程式为3NF3+5H2O═2NO↑+HNO3+9HF,根据NCl3与转移电子之间的关系式得,转移电子数=
×1×(5-3)×NA/mol=2.408×1023,
故答案为:3NF3+5H2O═2NO↑+HNO3+9HF;2.408×1023.
1mol Y的单质分别与足量盐酸和氢氧化钠溶液反应生成的气体在标况下均为33.6L,则Y为Al元素;
W的原子最外层电子数与核外电子总数之比为3:8,且W位于第三周期,则W为最外层电子数为S元素;
X的原子序数是Z的原子序数的一半,则Z为Si元素;
P元素为短周期主族元素且原子序数大于W,则P为Cl元素,
(1)Y为Al元素,Al在周期表中的位置是第三周期第IIIA族;X的氢化物是氨气,P的氯化氢是HCl,二者相互接近有白烟生成,其成分为氯化铵固体,故答案为:第三周期第IIIA族;有白烟生成;
(2)W是S元素、P是Cl元素,W与P可形成原子个数比为1:2的化合物为SCl2,每个Cl原子和S原子形成一对共用电子对,其电子式为
 ,故答案为:
,故答案为: ;
;(3)Y为Al元素、P为Cl元素,Y与P形成的化合物为为AlCl3,氯化铝为强酸弱碱盐,铝离子水解而使溶液呈酸性,水解方程式为Al3++3H2O?Al(OH)3+3H+,故答案为:酸;Al3++3H2O?Al(OH)3+3H+;
(4)Z为Si元素、W为S元素、P为Cl元素,非金属性Cl>S>Si,所以氢化物的稳定性HCl>H2S>SiH4,故答案为:HCl>H2S>SiH4;
(5)NCl3在潮湿的环境中能与水发生反应生成无色气体,遇空气变为红棕色,说明生成NO,同时还生成硝酸和氢氟酸,该反应的化学方程式为3NF3+5H2O═2NO↑+HNO3+9HF,根据NCl3与转移电子之间的关系式得,转移电子数=
| 0.6mol |
| 3 |
故答案为:3NF3+5H2O═2NO↑+HNO3+9HF;2.408×1023.
点评:本题考查了元素位置结构性质的关系及应用,涉及氧化还原反应、元素周期律、物质结构、盐类水解等知识点,根据物质结构、元素周期律、物质性质等知识点分析解答,注意(5)中三氟化氮的性质,其转移电子数的计算为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列各组物质中,一定属于同系物的是( )
| A、甲酸、硬脂酸 |
| B、CH4O、C2H6O |
C、 |
| D、CH3OH、CH2(OH)CH2OH |
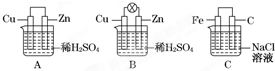 观察图A、B、C,回答下列问题:
观察图A、B、C,回答下列问题: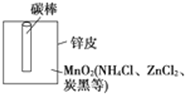 某学校设计了一节实验活动课,让学生从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质.整个实验过程如下,请回答有关问题:
某学校设计了一节实验活动课,让学生从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质.整个实验过程如下,请回答有关问题: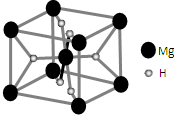 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.