题目内容
请根据所学化学知识回答下列问题:
已知0.01mol?L-1的NaHCO3溶液呈碱性.
(1)该溶液体系中存在着三个平衡,用电离方程式或离子方程式表示:
①HCO3-H++CO32- ②HCO3-+H2O H2CO3+OH-③ .
(2)该溶液中共有 种不同的粒子(指分子和离子).
(3)该溶液中的离子浓度由大到小的顺序是: .
(4)向该溶液中加入AlCl3溶液,有白色胶状沉淀生成,同时产生一种无色无味并能使澄清石灰水变浑浊的气体,写出向该溶液中加入AlCl3溶液反应的离子方程式: .
已知0.01mol?L-1的NaHCO3溶液呈碱性.
(1)该溶液体系中存在着三个平衡,用电离方程式或离子方程式表示:
①HCO3-H++CO32- ②HCO3-+H2O H2CO3+OH-③
(2)该溶液中共有
(3)该溶液中的离子浓度由大到小的顺序是:
(4)向该溶液中加入AlCl3溶液,有白色胶状沉淀生成,同时产生一种无色无味并能使澄清石灰水变浑浊的气体,写出向该溶液中加入AlCl3溶液反应的离子方程式:
考点:盐类水解的原理,离子方程式的书写,离子浓度大小的比较
专题:
分析:(1)存在水的电离平衡、碳酸氢根离子的电离平衡、碳酸氢根离子的水解平衡;
(2)含水、碳酸分子、氢离子、氢氧根离子、碳酸根离子、碳酸氢根离子、钠离子;
(3)NaHCO3溶液呈碱性HCO3-的水解程度大于电离程度;
(4)HCO3-与Al3+发生相互促进的水解,生成二氧化碳和氢氧化铝沉淀.
(2)含水、碳酸分子、氢离子、氢氧根离子、碳酸根离子、碳酸氢根离子、钠离子;
(3)NaHCO3溶液呈碱性HCO3-的水解程度大于电离程度;
(4)HCO3-与Al3+发生相互促进的水解,生成二氧化碳和氢氧化铝沉淀.
解答:
解:(1)NaHCO3溶液中存在HCO3-的电离和水解方程,及水的电离方程,所以溶液中的平衡方程式有:HCO3-?H++CO32-,HCO3-+H2O?H2CO3+OH-,H2O?H++OH-;
故答案为③H2O?H++OH-;
(2)NaHCO3溶液中存在HCO3-?H++CO32-,HCO3-+H2O?H2CO3+OH-,H2O?H++OH-,所以溶液中的微粒有HCO3-、H+、CO32-、H2CO3、H2O、OH-、Na+,则溶液中共有7中微粒;故答案为:7;
(3)NaHCO3溶液呈碱性,HCO3-的水解程度大于电离程度,所以该溶液中的离子浓度由大到小的顺序是c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);
故答案为:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);
(4)HCO3-与Al3+发生相互促进的水解,生成二氧化碳和氢氧化铝沉淀,其反应的离子方程式为:3HCO3-+Al3+═Al(OH)3↓+3CO2↑;
故答案为:3HCO3-+Al3+═Al(OH)3↓+3CO2↑.
故答案为③H2O?H++OH-;
(2)NaHCO3溶液中存在HCO3-?H++CO32-,HCO3-+H2O?H2CO3+OH-,H2O?H++OH-,所以溶液中的微粒有HCO3-、H+、CO32-、H2CO3、H2O、OH-、Na+,则溶液中共有7中微粒;故答案为:7;
(3)NaHCO3溶液呈碱性,HCO3-的水解程度大于电离程度,所以该溶液中的离子浓度由大到小的顺序是c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);
故答案为:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);
(4)HCO3-与Al3+发生相互促进的水解,生成二氧化碳和氢氧化铝沉淀,其反应的离子方程式为:3HCO3-+Al3+═Al(OH)3↓+3CO2↑;
故答案为:3HCO3-+Al3+═Al(OH)3↓+3CO2↑.
点评:本题考查了盐的水解、水解方程和电离方程是书写、溶液中离子种类,盐类水解分析判断,侧重于反应原理的应用的考查,题目综合性较强,难度中等.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
常温下,下列各组离子在制定溶液中一定能大量共存的是( )
| A、在水溶液中:H+、I-、ClO-、SiO32- |
| B、酸性溶液中:H+、NH4+、Al3+、SO42- |
| C、碱性溶液中:Na+、Al3+、AlO2-、I- |
| D、饱和氯水中:OH-、CO32-、Na+、SO32- |
已知:(1)H2(g)+O2(g)═H2O(g)△H1=a kJ?mol-1
(2)2H2(g)+O2(g)═2H2O(g)△H2=b kJ?mol-1
(3)H2(g)+O2(g)═H2O(l)△H3=c kJ?mol-1
(4)2H2(g)+O2(g)═2H2O(l)△H4=d kJ?mol-1
下列关系式中正确的是 ( )
(2)2H2(g)+O2(g)═2H2O(g)△H2=b kJ?mol-1
(3)H2(g)+O2(g)═H2O(l)△H3=c kJ?mol-1
(4)2H2(g)+O2(g)═2H2O(l)△H4=d kJ?mol-1
下列关系式中正确的是 ( )
| A、a<c<0 |
| B、b>d>0 |
| C、2a=b<0 |
| D、2c=d>0. |
下列叙述正确的是( )
| A、100℃纯水的pH<7,说明升温可导致水呈酸性 |
| B、0.2 mol?L-1的盐酸与等体积水混合后pH=1 |
| C、能自发进行的化学反应,一定是△H<0△S>0 |
| D、Na2CO3溶液中:c(Na+)+c(H+)═c(HCO3-)+c(CO32-)+c(OH-) |
下列物质属于电解质的是( )
| A、铜 |
| B、AgNO3 |
| C、蔗糖 |
| D、硫酸 |
下列实验操作或实验所得出的结论正确的是( )
A、 实验室中浓硝酸应保存在棕色细口瓶中,并贴有如图所示标签 |
| B、制备Fe(OH)3胶体时,应向沸水中逐滴加入1mol?L-1的FeCl3溶液,并继续加热到液体呈透明的红褐色为止 |
| C、用托盘天平称取5.85g NaCl,称量时砝码放在右盘,氯化钠放在左盘 |
| D、用50mL量筒量取5.6mL浓硫酸 |
| E、用四氯化碳萃取碘水中的碘,分液时有机层从分液漏斗的下端放出 |
| F、用广泛pH试纸测得某溶液的pH为4.8 |
我国是世界上严重缺碘的地区,全国有约四亿多人缺碘,因此我国政府规定:国内销售的食盐必须加碘,食盐中加的碘是什么物质( )
| A、I2 |
| B、KI |
| C、KIO3 |
| D、I- |
 某学习小组用0.10mol?L-1的标准NaOH溶液滴定20.00mL某未知浓度的酸HA,指示剂变色时认为酸碱恰好反应,此时测得溶液的pH为8.7.该小组绘制的滴定曲线如图:
某学习小组用0.10mol?L-1的标准NaOH溶液滴定20.00mL某未知浓度的酸HA,指示剂变色时认为酸碱恰好反应,此时测得溶液的pH为8.7.该小组绘制的滴定曲线如图: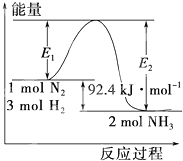 合成氨工业的核心反应是:N2(g)+3H2(g)
合成氨工业的核心反应是:N2(g)+3H2(g)