题目内容
常温下,下列各组离子在制定溶液中一定能大量共存的是( )
| A、在水溶液中:H+、I-、ClO-、SiO32- |
| B、酸性溶液中:H+、NH4+、Al3+、SO42- |
| C、碱性溶液中:Na+、Al3+、AlO2-、I- |
| D、饱和氯水中:OH-、CO32-、Na+、SO32- |
考点:离子共存问题
专题:
分析:A.次氯酸根离子具有强氧化性,能够氧化碘离子;次氯酸根离子、硅酸根离子能够与氢离子反应生成弱电解质;
B.H+、NH4+、Al3+、SO42-离子之间不满足离子反应发生条件,且都不与酸性溶液反应;
C.铝离子与偏铝酸根离子发生双水解反应生成氢氧化铝沉淀,铝离子还与氢氧根离子反应;
D.饱和氯水具有酸性、强氧化性,氢氧根离子、碳酸根离子能够与氢离子反应;亚硫酸根离子能够倍氯水氧化.
B.H+、NH4+、Al3+、SO42-离子之间不满足离子反应发生条件,且都不与酸性溶液反应;
C.铝离子与偏铝酸根离子发生双水解反应生成氢氧化铝沉淀,铝离子还与氢氧根离子反应;
D.饱和氯水具有酸性、强氧化性,氢氧根离子、碳酸根离子能够与氢离子反应;亚硫酸根离子能够倍氯水氧化.
解答:
解:A.I-、ClO-之间能够发生氧化还原反应,H+与ClO-、SiO32-发生反应生成弱酸,在溶液中不能大量共存,故A错误;
B.酸性溶液中存在大量氢离子,H+、NH4+、Al3+、SO42-离子之间不发生反应,都不与氢离子反应,在溶液中能够大量共存,故B正确;
C.碱性溶液中存在大量氢氧根离子,Al3+与氢氧根离子反应,Al3+、AlO2-之间发生双水解反应生成氢氧化铝,在溶液中不能大量共存,故C错误;
D.饱和氯水具有强氧化性,其溶液中含有大量氢离子,OH-、CO32-与氢离子反应,SO32-能够被氯水氧化,在溶液中一定不能大量共存,故D错误;
故选B.
B.酸性溶液中存在大量氢离子,H+、NH4+、Al3+、SO42-离子之间不发生反应,都不与氢离子反应,在溶液中能够大量共存,故B正确;
C.碱性溶液中存在大量氢氧根离子,Al3+与氢氧根离子反应,Al3+、AlO2-之间发生双水解反应生成氢氧化铝,在溶液中不能大量共存,故C错误;
D.饱和氯水具有强氧化性,其溶液中含有大量氢离子,OH-、CO32-与氢离子反应,SO32-能够被氯水氧化,在溶液中一定不能大量共存,故D错误;
故选B.
点评:本题考查离子共存的正误判断,为中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;氯水具有强氧化性和酸性等.

练习册系列答案
相关题目
下列各组中的离子能在溶液中大量共存,向溶液中加入NaOH溶液时产生沉淀,且加入盐酸时放出气体的离子组是( )
| A、OH-、Ba2+、NO3-、K+ |
| B、Fe2+、Ca2+、Br-、NO3- |
| C、Na+、SO42-、Cu2+、Cl- |
| D、CO32-、Cl-、Na+、Ba2+ |
粗食盐的杂质主要是MgCl2.为了除去杂质,工业上常把粗盐粉碎后用饱和食盐水浸洗,再过滤出食盐.对此,下面的评论正确的是( )
| A、浸洗前后,被浸洗的食盐中MgCl2的含量基本不变 |
| B、用来浸洗的饱和食盐水在浸洗前后没有变化 |
| C、浸洗用过的饱和食盐水可以无限次地使用下去 |
| D、粉碎颗粒的大小影响浸洗后盐中MgCl2的含量 |
以Al2(SO4)3溶液为原料之一,在实验室里制取少量Al(OH)3,并且易于分离,最好向溶液中加入( )
| A、NaOH 溶液 |
| B、氢氧化钡溶液 |
| C、氨水溶液 |
| D、澄清石灰水 |
 CuI是一种不溶于水的白色固体,它可以由反应:2Cu2++4I-═2CuI↓+I2而得到.如图所示装置中,a、b都是惰性电极,通电一段时间后,在KI淀粉溶液中阳极周围变蓝色,则下列说法正确的是( )
CuI是一种不溶于水的白色固体,它可以由反应:2Cu2++4I-═2CuI↓+I2而得到.如图所示装置中,a、b都是惰性电极,通电一段时间后,在KI淀粉溶液中阳极周围变蓝色,则下列说法正确的是( )| A、若a极变红,则在Pt电极上:2I--2e-═I2,淀粉遇碘变蓝 |
| B、若b极变红,则在Pt电极上:4OH--4e-═2H2O+O2↑,O2将I-氧化为I2,淀粉遇碘变蓝 |
| C、若a极变红,则在Cu电极上:2Cu+4I--4e-═2CuI↓+I2,碘遇淀粉变蓝 |
| D、若b极变红,则在Cu极上:Cu-2e-═Cu2+,Cu2+显蓝色 |
在2A(g)+3B(g)=C(g)+4D(g)的反应中,下列表示该反应的化学反应速度最快的是( )
| A、v (A)=0.5 mol/(L?s) |
| B、v (B)=0.9 mol/(L?s) |
| C、v (C)=0.8 mol/(L?s) |
| D、v (D)=1.0 mol/(L?s) |
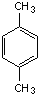 可命名为
可命名为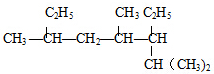 的系统命名为
的系统命名为