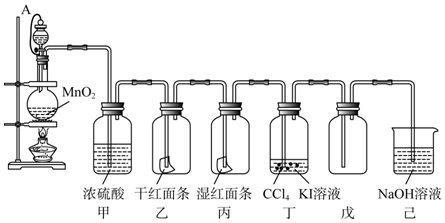
题目内容
20.现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出).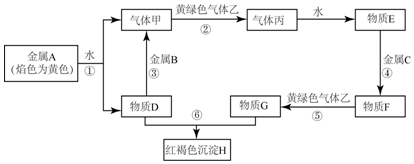
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:BAl,FFeCl2,HFe(OH)3,乙Cl2
(2)反应③的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑;反应⑤的离子方程式:2Fe+Cl2=2Fe3++2Cl-;
(3)物质G可用作印刷铜制钱线路板的“腐蚀液”.写出物质G与单质铜反应的离子方程式:2Fe3++Cu=2Fe2++Cu2+
(4)若在F溶液中加入D溶液,并露至于空气中,能观察到的现象是先产生白色沉淀,然后沉淀变成灰绿色,最后变成红褐色
(5)气体乙通入冷的消石灰中制得漂白粉,反应方程式为Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O.
分析 金属A焰色反应为黄色,故A为Na,乙是黄绿色气体,乙为Cl2,H为红褐色沉淀,为Fe(OH)3.由反应①Na+水→气体甲+D,故甲为H2,D为NaOH.由NaOH+金属B→H2可知,B为金属Al,由甲+乙→丙,故丙为HCl,HCl溶于水的物质E,故E为盐酸;G+NaOH→Fe(OH)3,G含有Fe3+,由E(盐酸)+金属C→F、F+氯气→G,可知C为Fe,F为FeCl2,G为FeCl3,据此解答.
解答 解:(1)由以上分析可知,B为Al,F为FeCl2,H为Fe(OH)3,乙为Cl2;
故答案为:Al,FeCl2,Fe(OH)3,Cl2;
(2)反应③的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
反应⑤的离子方程式为:2Fe+Cl2=2Fe3++2Cl-,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;2Fe+Cl2=2Fe3++2Cl-;
(3)G为FeCl3,物质G可用作印刷铜制钱线路板的“腐蚀液”,物质G与单质铜反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+,
故答案为:2Fe3++Cu=2Fe2++Cu2+;
(4)若在FeCl2溶液中加入NaOH溶液,并露置于空气中,首先发生反应FeCl2+2NaOH=Fe(OH)2↓+2NaCl,迅速发生反应:4Fe(OH)2+O2+2H2O=4Fe(OH)3,能观察到的现象是:先产生白色沉淀,然后沉淀变成灰绿色,最后变成红褐色,
故答案为:先产生白色沉淀,然后沉淀变成灰绿色,最后变成红褐色;
(5)乙为Cl2,气体乙通入冷的消石灰中制得漂白粉,反应方程式为Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O,
故答案为:Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O.
点评 本题以无机框图题的形式考查Na、Al、Fe、Cl等元素单质及其化合物之间的相互转化关系、化学用语的书等,关键是能根据物质的特性颜色为突破口进行推断,难度中等.

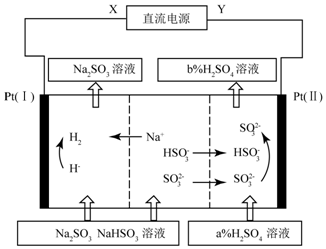
| A. | X为直流电源的正极,Y为直流电流的负极 | |
| B. | 图中的b<a | |
| C. | P(I)附近溶液的pH减小,Pt(II)附近溶液的pH增大 | |
| D. | 再生机理为:Pt(I)H+放电,导致“HSO3-?SO2-+H+”平衡右移 |
| A. | 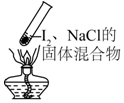 加热时,上部汇聚了固体碘,说明碘的热稳定性较差 | |
| B. | 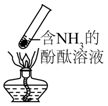 加热时,中部溶液变红,冷却后又变为无色 | |
| C. | 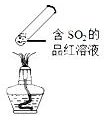 加热时,中部溶液变红,冷却后又变为无色 | |
| D. |  \加热时,上部汇聚了白色固体,说明氯化铵易升华 |
| A. | 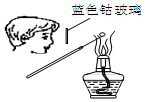 检验Na2CO3 中的Na+ | B. | 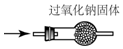 除去CO中混有的CO2 | ||
| C. | 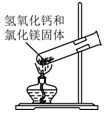 制取氨气 | D. | 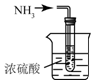 吸收氨气 |
| 编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/ml | 100mL | 200mL | 300mL | 400mL |
| 剩余金属/g | 18.0g | 9.6g | 0 | 0 |
| NO体积/L | 2.24L | 4.48L | 6.7L | V |
(1)硝酸的浓度.
(2)每份金属混合物的总质量.
(3)实验④中V的值.
| A. | 用稀硫酸溶解四氧化三铁:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | Ca(HCO2)2溶液中滴加Ba(OH)2溶液至呈中性:Ca2++2HCO3-+Ca2++2OH-═2H2O+BaCO3↓+CaCO3↓ | |
| C. | 向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:H++SO42-+Ba2++OH-═H2O+BaSO4↓ | |
| D. | 向次氯酸钠溶液中通入SO2:2ClO-+SO2+H2O═SO32-+2HClO |
| A. | 28 g氮气含有的原子数为NA | |
| B. | 标准状况下,22.4 L水中含有的水分子数为NA | |
| C. | 1 molOH-含有的电子数为10NA | |
| D. | 0.1 L 1 mol•L-1NaCl溶液中含有Na+个数为NA |
| A. | Cl- | B. | HClO | C. | HCl | D. | Cl2 |