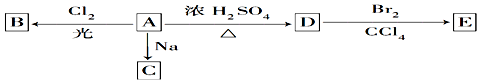题目内容
9.用NA表示阿伏加德罗常数的值.下列说法正确的是( )| A. | 28 g氮气含有的原子数为NA | |
| B. | 标准状况下,22.4 L水中含有的水分子数为NA | |
| C. | 1 molOH-含有的电子数为10NA | |
| D. | 0.1 L 1 mol•L-1NaCl溶液中含有Na+个数为NA |
分析 A、氮气由氮原子构成;
B、标况下水为液体;
C、氢氧根中含10个电子;
D、求出氯化钠的物质的量,然后根据氯化钠中含一个钠离子来分析.
解答 解:A、氮气由氮原子构成,故28g氮气中含有的氮原子的物质的量为2mol,故含2NA个,故A错误;
B、标况下水为液体,故不能根据气体摩尔体积来计算其物质的量,故B错误;
C、氢氧根中含10个电子,故1mol氢氧根中含10NA个电子,故C正确;
D、溶液中的氯化钠的物质的量n=CV=1mol/L×0.1L=0.1mol,而氯化钠中含一个钠离子,故0.1mol氯化钠中含0.1NA个钠离子,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
4.一块11.0g的铁铝合金,加入一定量的稀硫酸后完全溶解,然后加H2O2至溶液中无Fe2+存在,加热除去多余的H2O2,当加入200mL 6mol•L-1 NaOH溶液时沉淀量最多,且所得沉淀质量为26.3g,下列说法正确的是( )
| A. | 该合金中铁的质量为5.4 g | |
| B. | 合金与稀硫酸反应共生成0.45 mol H2 | |
| C. | 该合金与足量氢氧化钠溶液反应,转移的电子数为0.3NA | |
| D. | 所加的稀硫酸中含0.6 mol H2SO4 |
7.在密闭容器中发生下列反应aA(g)?cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,C的浓度为原平衡的2.1倍,下列叙述不正确的是( )
| A. | A的转化率变大 | B. | a<c+d | ||
| C. | A的质量分数变小 | D. | 平衡向正反应方向移动 |
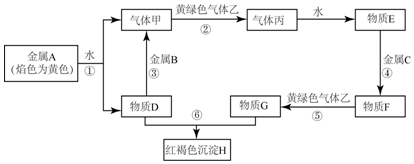
 (1)为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将100g样品加热使其质量不再变化,其质量变为96.9%,则该样品的纯度(质量分数)是91.6%
(1)为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将100g样品加热使其质量不再变化,其质量变为96.9%,则该样品的纯度(质量分数)是91.6%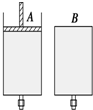 如图所示,有两只密闭容器A和B,A容器有一个移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两只容器中分别充入等量的体积比为2:1的SO2与O2的混合气体,并使A和B容积相等(如图).在保持400℃的条件下使之发生如下反应:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g),填写下列空格.
如图所示,有两只密闭容器A和B,A容器有一个移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两只容器中分别充入等量的体积比为2:1的SO2与O2的混合气体,并使A和B容积相等(如图).在保持400℃的条件下使之发生如下反应:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g),填写下列空格. (1)若向Mg(OH)2浊液中滴入足量的FeCl3溶液,振荡后,白色沉淀会全部转化为红褐色沉淀,试从平衡的角度解释沉淀转化的原因:氢氧化镁浊液中存在沉淀溶解平衡:Mg(OH)2?Mg2++2OH-,由于KSP[Fe(OH)3]<KSP[Mg(OH)2],所以当加入Fe3+后,会和OH-反应生成更难溶的氢氧化铁沉淀,使得上述平衡正向移动,最有氢氧化镁全部转化为红褐色的氢氧化铁沉淀
(1)若向Mg(OH)2浊液中滴入足量的FeCl3溶液,振荡后,白色沉淀会全部转化为红褐色沉淀,试从平衡的角度解释沉淀转化的原因:氢氧化镁浊液中存在沉淀溶解平衡:Mg(OH)2?Mg2++2OH-,由于KSP[Fe(OH)3]<KSP[Mg(OH)2],所以当加入Fe3+后,会和OH-反应生成更难溶的氢氧化铁沉淀,使得上述平衡正向移动,最有氢氧化镁全部转化为红褐色的氢氧化铁沉淀