题目内容
3.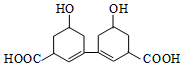 中国是中草药的发源地,目前中国大约有12000种药用植物.从某中草药提取的有机物结构如图所示,该有机物的下列说法中错误的是( )
中国是中草药的发源地,目前中国大约有12000种药用植物.从某中草药提取的有机物结构如图所示,该有机物的下列说法中错误的是( )| A. | 该物质的熔点比同碳的烃分子熔点高 | |
| B. | 分子式为C14H18O4 | |
| C. | 1mol该有机物与足量的金属钠反应产生4molH2 | |
| D. | 环上氢原子的一氯取代物5种 |
分析 由结构可知,分子中含-OH、-COOH、碳碳双键,结合醇、羧酸、烯烃的性质来解答.
解答 解:A.含有-O-H键,分子间可形成氢键,沸点不烃的高,故A正确;
B.由结构可知,分子式为C14H18O4,故B正确;
C.能与钠反应的为羟基和羧基,1mol该有机物与足量的金属钠反应产生2molH2,故C错误;
D.结构对称,环上有5种H,环上氢原子的一氯取代物5种,故D正确.
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意常见官能团的性质,题目难度不大.

练习册系列答案
相关题目
13.下列有机物,不能溶于水的是( )
| A. | 酒精 | B. | 醋酸 | C. | 乙醛 | D. | 硝基苯 |
11.下列有关物质的性质与用途具有对应关系的是( )
| A. | 液氨气化吸热,可用作制冷剂 | B. | 明矾易溶于水,可用作净水剂 | ||
| C. | 盐酸具有还原性,可用于除去铁锈 | D. | 浓硝酸其有酸性,可用于钝化铁、铝 |
18.按照有机物的命名规则,下列命名正确的是( )
| A. | 1,2-二甲基戊烷 | B. | 2-乙基丁烷 | C. | 3-乙基己烷 | D. | 3,4-二甲基戊烷 |
8.某同学利用如图装置探究SO2的性质.
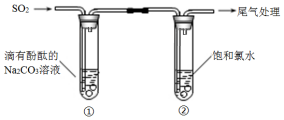
下列有关反应的方程式,不正确的是( )

下列有关反应的方程式,不正确的是( )
| A. | ①中溶液显红色的原因:CO32-+H2O?HCO3-+OH- | |
| B. | ①中溶液红色褪去的原因:2SO2+CO32-+H2O═CO2+2HSO3- | |
| C. | ②中溶液显黄绿色的原因:Cl2+H2O═HCl+HClO | |
| D. | ②中溶液黄绿色褪去的原因:SO2+Cl2+2H2O═H2SO4+2HCl |
15.下列反应是吸热反应的是( )
| A. | 灼热的炭与氧气碳反 应 | |
| B. | 铁和稀硫酸的反应 | |
| C. | 氢氧化钡晶体的粉末和氯化铵晶体混合 | |
| D. | 钢铁制品生锈的反应 |
12.甲醇又称“木精”,是非常重要的化工原料.
(1)CO和H2在高温、高压、催化剂条件下反应可制备甲醇.根据下表中相关化学键键能(键能是断裂1mol化学键时需要吸收的能量,或形成1mol化学键时释放的能量)数据,写出CO(CO分子中含有C=O)和H2反应生成甲醇的热化学方程式CO(g)+2H2(g)=CH3OH(g)△H=-105kJ•mol-1.
(2)甲醇脱氢可制取甲醛CH3OH(g)$\stackrel{脱氢}{?}$HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图1所示.
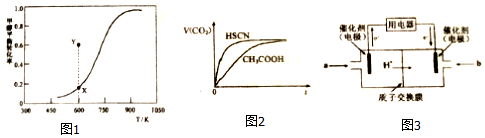
①该脱氢反应的△H>0(填“>”、“<”或“=”)
②600K时,Y点甲醇的V(正)<V(逆)(填“>”、“<”或“=”),判断依据是600K时Y点甲醇转化率大于X点甲醇平衡转化率,说明反应逆向进行即:υ(正)<υ(逆)
③下列叙述不能说明该脱氢反应已经达到平衡状态的是AD.
A.c(CH3OH)=c(HCHO) B.HCHO的体积分数保持不变
C.V正(CH3OH)=V逆(HCHO) D.混合气体平均分子量保持不变
(3)一定条件下,甲醇与一氧化碳反应可以合成乙酸.已知:常温下,弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5;Ka(HSCN)=0.13.
常温下,将20mL0.10mol•L-1CH3COOH溶液和20mL0.10mol•L-1HSCN溶液分别与20mL0.10mol•L-1NaHCO3溶液混合,实验测得产生CO2气体体积V随时间t变化的示意图如图2所示:
①反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快,反应结束后所得两溶液中,C(CH3COO-)< c(SCN-)(填“>”、“<”或“=”).
②常温条件下,将amol•L-1的CH3COOH与bmol•L-1Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为$\frac{2b}{a-2b}$×10-7L/mol.
(4)甲醇燃料电池可能成为未来便携电子产品应用的主流.某种甲醇燃料电池工作原理如图3所示,则通入a气体电极的电极反应式为CH3OH-6e-+H2O=CO2+6H+.
(1)CO和H2在高温、高压、催化剂条件下反应可制备甲醇.根据下表中相关化学键键能(键能是断裂1mol化学键时需要吸收的能量,或形成1mol化学键时释放的能量)数据,写出CO(CO分子中含有C=O)和H2反应生成甲醇的热化学方程式CO(g)+2H2(g)=CH3OH(g)△H=-105kJ•mol-1.
| 化学键 | H-H | O-H | C-H | C-O | C=O |
| 键能/KJ•mol-1 | 436 | 463 | 413 | 351 | 1076 |

①该脱氢反应的△H>0(填“>”、“<”或“=”)
②600K时,Y点甲醇的V(正)<V(逆)(填“>”、“<”或“=”),判断依据是600K时Y点甲醇转化率大于X点甲醇平衡转化率,说明反应逆向进行即:υ(正)<υ(逆)
③下列叙述不能说明该脱氢反应已经达到平衡状态的是AD.
A.c(CH3OH)=c(HCHO) B.HCHO的体积分数保持不变
C.V正(CH3OH)=V逆(HCHO) D.混合气体平均分子量保持不变
(3)一定条件下,甲醇与一氧化碳反应可以合成乙酸.已知:常温下,弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5;Ka(HSCN)=0.13.
常温下,将20mL0.10mol•L-1CH3COOH溶液和20mL0.10mol•L-1HSCN溶液分别与20mL0.10mol•L-1NaHCO3溶液混合,实验测得产生CO2气体体积V随时间t变化的示意图如图2所示:
①反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快,反应结束后所得两溶液中,C(CH3COO-)< c(SCN-)(填“>”、“<”或“=”).
②常温条件下,将amol•L-1的CH3COOH与bmol•L-1Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为$\frac{2b}{a-2b}$×10-7L/mol.
(4)甲醇燃料电池可能成为未来便携电子产品应用的主流.某种甲醇燃料电池工作原理如图3所示,则通入a气体电极的电极反应式为CH3OH-6e-+H2O=CO2+6H+.
13.绿原酸是从金银花中提取出的有很高药用价值的有机物,其结构如图所示,下列说法正确的是( )
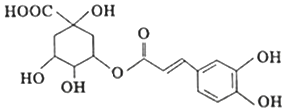

| A. | 绿原酸分子中有4种含氧官能团 | |
| B. | 绿原酸能发生取代、加成、消去和氧化反应 | |
| C. | 绿原酸在酸性条件下的水解产物均能与FeCl3发生显色反应 | |
| D. | l mol绿原酸与足量钠反应,可生成4 molH2 |
 A、B、C、D、E、F是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如下:
A、B、C、D、E、F是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如下: