题目内容
20.下列有关化学反应速率的说法正确的是( )| A. | 用铝片和硫酸反应制氢气,硫酸浓度越高,反应速率越快 | |
| B. | 锌和稀硫酸反应制氢气时,加入少量CuSO4溶液,可加快反应速率 | |
| C. | 增大压强、升高温度和使用催化剂均一定使反应速率加快 | |
| D. | 在碳酸钙和盐酸反应中,加多些碳酸钙可使反应速率明显如快 |
分析 A.常温下浓硫酸和Al发生钝化现象;
B.原电池能加快化学反应速率;
C.增大压强增大化学反应速率适用于有气体参加的化学反应;
D.碳酸钙是固体,碳酸钙和稀盐酸的化学反应速率快慢与碳酸钙的多少无关.
解答 解:A.常温下浓硫酸和Al发生氧化还原反应生成一层致密的氧化物薄膜而阻止进一步反应,且生成的气体不是氢气,故A错误;
B.Zn置换出硫酸铜中的Cu,Zn、Cu和稀硫酸构成原电池而加快化学反应速率,故B正确;
C.增大压强增大化学反应速率适用于有气体参加的化学反应,如果化学反应中没有气体参加反应,则压强不影响化学反应速率,如稀盐酸和NaOH溶液的反应,故C错误;
D.碳酸钙是固体,碳酸钙和稀盐酸的化学反应速率快慢与碳酸钙的多少无关,故D错误;
故选B.
点评 本题考查化学反应速率影响因素,为高频考点,明确温度、浓度、催化剂、压强对化学反应速率影响原理是解本题关键,注意各个影响因素的适用范围,题目难度不大.

练习册系列答案
相关题目
10.表是周期表中的一部分,根据A-I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是Ne,只有负价而无正价的是F,氧化性最强的单质是F2,还原性最强的单质是Na;
(2)最高价氧化物的水化物碱性最强的化合物是NaOH,酸性最强的化合物是HClO4,呈两性的化合物是Al(OH)3;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF;
(4)在B、C、D、E、F、G、H中,原子半径最大的是Na.
(5)写出E的单质的结构式N≡N:
(6)写出BG组成的化合物的形成过程 :
:
| 族周期 | ⅠA | 0 | ||||||
| 1 | A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物碱性最强的化合物是NaOH,酸性最强的化合物是HClO4,呈两性的化合物是Al(OH)3;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF;
(4)在B、C、D、E、F、G、H中,原子半径最大的是Na.
(5)写出E的单质的结构式N≡N:
(6)写出BG组成的化合物的形成过程
 :
:
11.下列有关物质的性质与用途具有对应关系的是( )
| A. | 液氨气化吸热,可用作制冷剂 | B. | 明矾易溶于水,可用作净水剂 | ||
| C. | 盐酸具有还原性,可用于除去铁锈 | D. | 浓硝酸其有酸性,可用于钝化铁、铝 |
8.某同学利用如图装置探究SO2的性质.
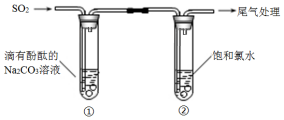
下列有关反应的方程式,不正确的是( )

下列有关反应的方程式,不正确的是( )
| A. | ①中溶液显红色的原因:CO32-+H2O?HCO3-+OH- | |
| B. | ①中溶液红色褪去的原因:2SO2+CO32-+H2O═CO2+2HSO3- | |
| C. | ②中溶液显黄绿色的原因:Cl2+H2O═HCl+HClO | |
| D. | ②中溶液黄绿色褪去的原因:SO2+Cl2+2H2O═H2SO4+2HCl |
15.下列反应是吸热反应的是( )
| A. | 灼热的炭与氧气碳反 应 | |
| B. | 铁和稀硫酸的反应 | |
| C. | 氢氧化钡晶体的粉末和氯化铵晶体混合 | |
| D. | 钢铁制品生锈的反应 |
5.下列所述实验中,现象和结论均正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 将硝酸亚铁加入稀硫酸中充分反应后滴加KSCN溶液 | 有气体生成,溶液呈红色 | 硫酸有强氧化性 |
| B | Na[Al(OH)4]溶液中滴入NaHCO3 | 产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| C | Na2CO3溶液中滴入酚酞 | 溶液变红 | 能水解的盐溶液中的水的电离度一定比纯水的大 |
| D | 将少量氯水滴在淀粉-KI试纸上 | 试纸中间褪色,试纸边缘变蓝 | 氯气既有氧化性又有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
12.甲醇又称“木精”,是非常重要的化工原料.
(1)CO和H2在高温、高压、催化剂条件下反应可制备甲醇.根据下表中相关化学键键能(键能是断裂1mol化学键时需要吸收的能量,或形成1mol化学键时释放的能量)数据,写出CO(CO分子中含有C=O)和H2反应生成甲醇的热化学方程式CO(g)+2H2(g)=CH3OH(g)△H=-105kJ•mol-1.
(2)甲醇脱氢可制取甲醛CH3OH(g)$\stackrel{脱氢}{?}$HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图1所示.
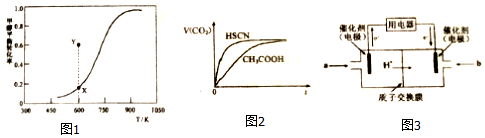
①该脱氢反应的△H>0(填“>”、“<”或“=”)
②600K时,Y点甲醇的V(正)<V(逆)(填“>”、“<”或“=”),判断依据是600K时Y点甲醇转化率大于X点甲醇平衡转化率,说明反应逆向进行即:υ(正)<υ(逆)
③下列叙述不能说明该脱氢反应已经达到平衡状态的是AD.
A.c(CH3OH)=c(HCHO) B.HCHO的体积分数保持不变
C.V正(CH3OH)=V逆(HCHO) D.混合气体平均分子量保持不变
(3)一定条件下,甲醇与一氧化碳反应可以合成乙酸.已知:常温下,弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5;Ka(HSCN)=0.13.
常温下,将20mL0.10mol•L-1CH3COOH溶液和20mL0.10mol•L-1HSCN溶液分别与20mL0.10mol•L-1NaHCO3溶液混合,实验测得产生CO2气体体积V随时间t变化的示意图如图2所示:
①反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快,反应结束后所得两溶液中,C(CH3COO-)< c(SCN-)(填“>”、“<”或“=”).
②常温条件下,将amol•L-1的CH3COOH与bmol•L-1Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为$\frac{2b}{a-2b}$×10-7L/mol.
(4)甲醇燃料电池可能成为未来便携电子产品应用的主流.某种甲醇燃料电池工作原理如图3所示,则通入a气体电极的电极反应式为CH3OH-6e-+H2O=CO2+6H+.
(1)CO和H2在高温、高压、催化剂条件下反应可制备甲醇.根据下表中相关化学键键能(键能是断裂1mol化学键时需要吸收的能量,或形成1mol化学键时释放的能量)数据,写出CO(CO分子中含有C=O)和H2反应生成甲醇的热化学方程式CO(g)+2H2(g)=CH3OH(g)△H=-105kJ•mol-1.
| 化学键 | H-H | O-H | C-H | C-O | C=O |
| 键能/KJ•mol-1 | 436 | 463 | 413 | 351 | 1076 |

①该脱氢反应的△H>0(填“>”、“<”或“=”)
②600K时,Y点甲醇的V(正)<V(逆)(填“>”、“<”或“=”),判断依据是600K时Y点甲醇转化率大于X点甲醇平衡转化率,说明反应逆向进行即:υ(正)<υ(逆)
③下列叙述不能说明该脱氢反应已经达到平衡状态的是AD.
A.c(CH3OH)=c(HCHO) B.HCHO的体积分数保持不变
C.V正(CH3OH)=V逆(HCHO) D.混合气体平均分子量保持不变
(3)一定条件下,甲醇与一氧化碳反应可以合成乙酸.已知:常温下,弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5;Ka(HSCN)=0.13.
常温下,将20mL0.10mol•L-1CH3COOH溶液和20mL0.10mol•L-1HSCN溶液分别与20mL0.10mol•L-1NaHCO3溶液混合,实验测得产生CO2气体体积V随时间t变化的示意图如图2所示:
①反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快,反应结束后所得两溶液中,C(CH3COO-)< c(SCN-)(填“>”、“<”或“=”).
②常温条件下,将amol•L-1的CH3COOH与bmol•L-1Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为$\frac{2b}{a-2b}$×10-7L/mol.
(4)甲醇燃料电池可能成为未来便携电子产品应用的主流.某种甲醇燃料电池工作原理如图3所示,则通入a气体电极的电极反应式为CH3OH-6e-+H2O=CO2+6H+.
9.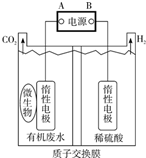 在微生物作用下电解有机废水(含CH3COOH),可获得清洁能源H2,其原理如图所示,下列有关说法不正确的是( )
在微生物作用下电解有机废水(含CH3COOH),可获得清洁能源H2,其原理如图所示,下列有关说法不正确的是( )
 在微生物作用下电解有机废水(含CH3COOH),可获得清洁能源H2,其原理如图所示,下列有关说法不正确的是( )
在微生物作用下电解有机废水(含CH3COOH),可获得清洁能源H2,其原理如图所示,下列有关说法不正确的是( )| A. | 电极B极为负极 | |
| B. | 与电源A极相连的惰性电极上发生的反应为:CH3COOH-8e-+H2O=2CO2↑+8H+ | |
| C. | 通电后,H+通过质子交换膜向右移动,最终右侧溶液pH减小 | |
| D. | 通电后,若有0.1molH2生成,则转移0.2mol电子 |
14.利用如图所示装置可制取 H2,两个电极均为惰性电极,c 为阴离子交换膜.下列叙述正确的是( )

| A. | a 为电源的正极 | |
| B. | 工作时,OH-向左室迁移 | |
| C. | 右室电极反应为:C2H5OH+H2O-4e-═CH3COO-+5H+ | |
| D. | 生成 H2 和 CH3COONa 的物质的量之比为 2:1 |