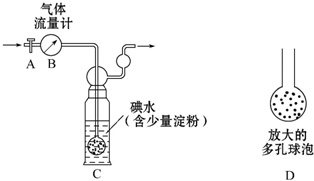
题目内容
6. 锂及锂盐具有的优异性能和特殊功能,在化工、电子、宇航、核能、能源等领域都得到广泛应用,因此锂元素被誉为“能源元素”.请回答下列问题:
锂及锂盐具有的优异性能和特殊功能,在化工、电子、宇航、核能、能源等领域都得到广泛应用,因此锂元素被誉为“能源元素”.请回答下列问题:(1)锂的原子结构示意图为
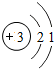 ;
;(2)写出锂在空气中燃烧的化学方程式4Li+O2$\frac{\underline{\;点燃\;}}{\;}$2Li2O;
(3)2014年在上海首飞的C919大飞机采用了大量新材料铝锂合金.下列有关铝锂合金的说法不正确的是D;
A.铝锂合金是铝和锂形成的混合物 B.铝锂合金的硬度比锂大
C.铝锂合金的熔沸点比铝低 D.铝锂合金耐酸碱腐蚀
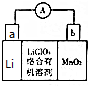
(4)由于锂密度小,活动性强,是制造电池的理想物质.锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶体中,生成LiMnO2.
①外电路的电流方向是由b极流向a极(填字母);
②电池负极反应式为Li-e-=Li+;
③是否可用水代替电池中的混合有机溶剂否(填“是”或“否”),原因是锂是活泼电极,可以和水之间发生反应;
④MnO2可与KOH和KClO3在高温下反应生成K2MnO4,反应的化学方程式为3MnO2+KClO3+6KOH$\frac{\underline{\;高温\;}}{\;}$3K2MnO4+KCl+3H2O;K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为2:1.
分析 (1)根据原子结构示意图的画法来回答;
(2)金属锂在空气中燃烧生成氧化锂,据此书写方程式;
(3)合金具有:硬度一般比组成合金的各成分硬度高,密度小,熔沸点比单一成分低的特点;
(4)形成原电池反应时,Li为负极,被氧化,电极方程式为Li-e-=Li+,MnO2为正极,被还原,电极方程式为MnO2+e-+Li+=LiMnO2,结合电极方程式以及元素化合价的变化解答该题.
解答 解:(1)锂原子结构示意图为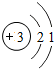 ,故答案为:
,故答案为: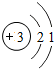 ;
;
(2)金属锂在空气中燃烧生成氧化锂,化学方程式为:4Li+O2$\frac{\underline{\;点燃\;}}{\;}$2Li2O,故答案为:4Li+O2$\frac{\underline{\;点燃\;}}{\;}$2Li2O;
(3)A.合金是混合物,故正确;
B.铝锂合金的硬度比单一成分金属锂的大,故正确;
C.铝锂合金的熔沸点比单一成分金属铝低,故正确;
D.铝锂合金具有金属铝和锂的性质,不能耐酸碱腐蚀,故D错误.
故选D;
(4)①Li为负极,MnO2为正极,原电池工作时,外电路的电流方向从正极到负极,即从b极流向a极,电子移动方向与电流相反,由a流向b,
故答案为:b;a;
②Li为负极,被氧化,电极方程式为Li-e-=Li+,故答案为:Li-e-=Li+;
③金属锂是活泼电极,可以和水之间发生反应,所以不能用水作电解质,故答案为:否;锂是活泼电极,可以和水之间发生反应;
④MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的方程式为3MnO2+KClO3+6KOH$\frac{\underline{\;高温\;}}{\;}$3K2MnO4+KCl+3H2O,
K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2,反应中Mn元素化合价分别由+6价升高到7价、降低到+4价,由氧化还原反应氧化剂和还原剂之间得失电子数目相等可知,生成KMnO4和MnO2的物质的量之比为2:1,
故答案为:3MnO2+KClO3+6KOH$\frac{\underline{\;高温\;}}{\;}$3K2MnO4+KCl+3H2O;2:1.
点评 本题侧重于电化学、合金得性质等知识的全面考查,题目难度适中,能很好地考查学生的分析能力、以及电化学知识的综合理解和运用,难度中等.

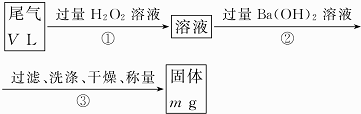
| A. | 测定时可用氯水代替过氧化氢氧化甲醛 | |
| B. | 足量H2O2氧化1molHCHO时放出的热量-定是①的2倍 | |
| C. | 上述方法测定甲醛含量时,如果H2O2过量,会导致甲醛含量的测定结果偏高 | |
| D. | H2O2氧化甲醛(反应①)和氧化甲酸的原理相同,氧化等量甲醛和甲酸时转移电子的数目也相同 |
| A. | 乙烯的结构简式为:C2H4 | |
| B. | S2-的结构示意图: | |
| C. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I | |
| D. | NH4Cl的电子式为: |
| A. | Zn | B. | Cu | C. | Fe | D. | Mg |
| A. | 3NA个原子 | B. | NA个分子 | C. | 2.0mol分子 | D. | 11.2L |
| A. | NO2被还原 | B. | CO是氧化剂 | C. | CO发生还原反应 | D. | NO2失去电子 |
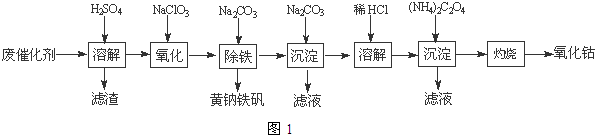
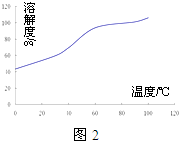 (4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)2•3Co(OH)2],沉淀需洗涤,洗涤的操作是向漏斗中加入蒸馏水至浸没沉淀,静置使滤液流出.重复操作2~3次.
(4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)2•3Co(OH)2],沉淀需洗涤,洗涤的操作是向漏斗中加入蒸馏水至浸没沉淀,静置使滤液流出.重复操作2~3次.