题目内容
15.化合物A是一种储氢容量高.安全性好的固体储氢材料,其储氢原理可表示为:A(s)+H2(g)$?_{释氢}^{贮藏}$ B(s)+LiH(s)△H=-44.5kJ•mol-1…①
已知:①在液氨中加入金属锂生成B和氢气;
②一定条件下,2.30g固体B与5.35gNH4Cl固体恰好完全反应,生成固体盐C和4,.48L气体D (已折算成标准状况);气体D能使湿润的红色石蕊试纸变蓝色.
(1)LiH中r(Li+)小于r(H-)(填“大于”或“小于”).
(2)写出液氨与金属锂反应的化学方程式2Li+2NH3=2LiNH2+H2.
分析 在一定条件下,2.30g固体B与5.35gNH4Cl固体恰好完全反应,生成固体C和4.48L气体D(标准状况),气体D能使湿润的红色石蕊试纸变蓝色,可推知D为NH3,电解4.48L氨气的物质的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,其质量=0.2mol×17g/mol=3.4g,根据质量守恒可知C的质量为2.3g+5.35g-3.4g=4.25g,NH4Cl的摩尔质量为53.5g/mol,5.35gNH4Cl为0.1mol,B中含Li,则固体B与NH4Cl固体反应可表为:B+NH4Cl→LiCl+NH3,根据Cl原子守恒,LiCl的物质的量=0.1mol,那么2.3g化合物B中含Li元素也为 0.1mol,再根据质量守恒和原子守恒(原子的种类和数目反应前后相同),则2.3gB中含有N原子为0.2mol-0.1mol=0.1mol,含有H原子为0.2mol×4-0.4mol=0.2mol,可推知B是LiNH2,液氨与金属锂反应生成氢气和LiNH2,
(1)离子半径大小,Li+,H-,电子层数相同,核电荷数越大半径越小;
(2)推知B是LiNH2,液氨与金属锂反应生成氢气和LiNH2;
解答 解:在一定条件下,2.30g固体B与5.35gNH4Cl固体恰好完全反应,生成固体C和4.48L气体D(标准状况),气体D能使湿润的红色石蕊试纸变蓝色,可推知D为NH3,电解4.48L氨气的物质的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,其质量=0.2mol×17g/mol=3.4g,根据质量守恒可知C的质量为2.3g+5.35g-3.4g=4.25g,NH4Cl的摩尔质量为53.5g/mol,5.35gNH4Cl为0.1mol,B中含Li,则固体B与NH4Cl固体反应可表为:B+NH4Cl→LiCl+NH3,根据Cl原子守恒,LiCl的物质的量=0.1mol,那么2.3g化合物B中含Li元素也为 0.1mol,再根据质量守恒和原子守恒(原子的种类和数目反应前后相同),则2.3gB中含有N原子为0.2mol-0.1mol=0.1mol,含有H原子为0.2mol×4-0.4mol=0.2mol,可推知B是LiNH2,液氨与金属锂反应生成氢气和LiNH2,
(1)离子半径大小,Li+,H-,电子层数相同,核电荷数越大半径越小,LiH中r(Li+)小于r(H-),故答案为:小于;
(2)推知B是LiNH2,液氨与金属锂反应生成氢气和LiNH2,反应的化学方程式为:2Li+2NH3=2LiNH2+H2,故答案为:2Li+2NH3=2LiNH2+H2;
点评 本题考查无机物推断,侧重考查学生对知识的迁移应用与综合分析解决问题能力,对学生的逻辑推理有较高的要求,把握A中含Li元素,B物质化学式的推断是解题关键,难度较大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 操作和现象 | 结论 | |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | HNO3分解生成了NO2 |
| B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| C | 向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 | 析出了NaHCO3 |
| D | 向无水乙醇中加入浓H2SO4,加热至170℃产生的气体通入酸性KMnO4溶液,红色褪去 | 使溶液褪色的气体是乙烯 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 石油分馏 | B. | 用蒸馏法制取蒸馏水 | ||
| C. | 干冰气化 | D. | 电解水制氧气 |
| A. | 2.24LNH3和CH4的混合气体,所含电子总数为2NA | |
| B. | 1mol乙醇(CH3CH2OH)分子中含有共价键总数为8NA | |
| C. | 1mol/LNa2CO3溶液中,含有CO32-离子数为NA | |
| D. | 6.4gCu与足量浓硝酸反应,用排水法收集的气体分子数为0.2NA |
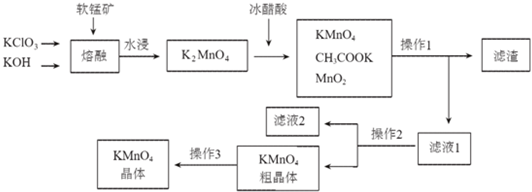
相关物质不同温度下的溶解度(单位:g)数据如表:
| 物质 温度 | KMnO4 | CH3COOK | K2SO4 | KCl |
| 20℃ | 6.34 | 217 | 11.1 | 34.2 |
| 90℃ | 45.2 | 398 | 22.9 | 53.9 |
(2)K2MnO4溶液中加入冰醋酸发生反应的离子方程式为:3MnO42-+4CH3COOH=2MnO4-+MnO2↓+2H2O+4CH3COO-.
(3)操作2是蒸发浓缩、冷却结晶、过滤.
(4)图中可以直接进行循环利用的物质是(填化学式)MnO2.
(5)KMnO4粗晶体中的主要杂质(填化学式)有KCl和CH3COOK,若用硫酸代替图中的冰醋酸,则导致的问题及原因是反应生成K2SO4,而K2SO4在常温下的溶解度也较小,析出后从而导致产品的纯度降低.
| A. | 原子序数 | B. | 电子数 | C. | 中子数 | D. | 质量数 |
 A,B,C,D,E,F是原子序数依次增大的六种前四周期元素,其相关信息如表所示:
A,B,C,D,E,F是原子序数依次增大的六种前四周期元素,其相关信息如表所示:| A | 原子半径最小的元素 |
| B | 原子核外电子有6种不同的运动状态 |
| D | 原子L电子层上有2对成对电子 |
| E | E与D同主族 |
| F | 基态F+核外有3层电子且各层均处于全满状态 |
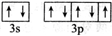 ;
;(2)B,C,D三种元素的基态原子第一电离能由小到大的顺序为C<O<N;(用元素符号表示)
(3)向F2+的硫酸盐溶液中滴加过量氨水,观察到的现象是首先生成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,其溶质的化学式为〔F(NH3)4]SO4,该物质的阳离子中的化学键有配位键和共价键(填“离子键”“共价键”“‘配位键”或“π键”);阴离子的空间构型为正四面体;
(4)B2A4分子中σ键与π键的个数比为5:1;
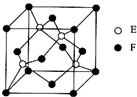
(5)E与F形成化合物晶体的晶胞如图所示.已知该晶胞的边长为a cm,则该晶体的化学式为CuS,密度为$\frac{384}{{a}^{3}{N}_{A}}$g/cm3(NA表示阿伏加德罗常数的值).
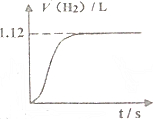 常温下在1LpH=3的HA溶液中加入过量铁粉,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积)
常温下在1LpH=3的HA溶液中加入过量铁粉,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积)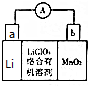 锂及锂盐具有的优异性能和特殊功能,在化工、电子、宇航、核能、能源等领域都得到广泛应用,因此锂元素被誉为“能源元素”.请回答下列问题:
锂及锂盐具有的优异性能和特殊功能,在化工、电子、宇航、核能、能源等领域都得到广泛应用,因此锂元素被誉为“能源元素”.请回答下列问题: ;
;