题目内容
18.标准状况下88gCO2有( )| A. | 3NA个原子 | B. | NA个分子 | C. | 2.0mol分子 | D. | 11.2L |
分析 标准状况下,Vm=22.4L/mol,带入n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$可计算出CO2的物质的量、分子数、体积,原子数为分子数的3倍.
解答 解:88gCO2的物质的量n=$\frac{m}{M}$=$\frac{88g}{44g/mol}$=2mol,分子数NA=2mol×NAmol-1=2NA,原子数为6NA,标准状况下,Vm=22.4L/mol,V=2mol×22.4L/mol=44.8L,
故选C.
点评 本题考查了物质的量的有关计算,难度不大,注意公式n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$中微粒具有一致性.

练习册系列答案
相关题目
9.若短周期元素可以形成A2B3型化合物,则两种元素的原子序数之差不可能是( )
| A. | 1 | B. | 3 | C. | 5 | D. | 6 |
13.下列物质暴露在空气中,会发生风化的是( )
| A. | 食盐 | B. | 石碱 | C. | 烧碱 | D. | 氧化钙 |
3.下列实验“操作和现象”与“结论”对应关系正确的是( )
| 操作和现象 | 结论 | |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | HNO3分解生成了NO2 |
| B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| C | 向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 | 析出了NaHCO3 |
| D | 向无水乙醇中加入浓H2SO4,加热至170℃产生的气体通入酸性KMnO4溶液,红色褪去 | 使溶液褪色的气体是乙烯 |
| A. | A | B. | B | C. | C | D. | D |
10.下列过程中,属于化学变化的是( )
| A. | 石油分馏 | B. | 用蒸馏法制取蒸馏水 | ||
| C. | 干冰气化 | D. | 电解水制氧气 |
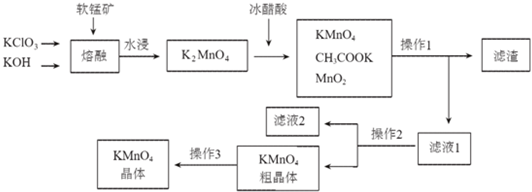
7.高锰酸钾是一种常用的氧化剂.下图是利用软锰矿(主要成分为MnO2)制备高锰酸钾的一种工艺(流程中部分产物已略去):
相关物质不同温度下的溶解度(单位:g)数据如表:
(1)“熔融”步骤反应的化学方程式为3MnO2+KClO3+6KOH$\frac{\underline{\;熔融\;}}{\;}$3K2MnO4+KCl+3H2O.
(2)K2MnO4溶液中加入冰醋酸发生反应的离子方程式为:3MnO42-+4CH3COOH=2MnO4-+MnO2↓+2H2O+4CH3COO-.
(3)操作2是蒸发浓缩、冷却结晶、过滤.
(4)图中可以直接进行循环利用的物质是(填化学式)MnO2.
(5)KMnO4粗晶体中的主要杂质(填化学式)有KCl和CH3COOK,若用硫酸代替图中的冰醋酸,则导致的问题及原因是反应生成K2SO4,而K2SO4在常温下的溶解度也较小,析出后从而导致产品的纯度降低.

相关物质不同温度下的溶解度(单位:g)数据如表:
| 物质 温度 | KMnO4 | CH3COOK | K2SO4 | KCl |
| 20℃ | 6.34 | 217 | 11.1 | 34.2 |
| 90℃ | 45.2 | 398 | 22.9 | 53.9 |
(2)K2MnO4溶液中加入冰醋酸发生反应的离子方程式为:3MnO42-+4CH3COOH=2MnO4-+MnO2↓+2H2O+4CH3COO-.
(3)操作2是蒸发浓缩、冷却结晶、过滤.
(4)图中可以直接进行循环利用的物质是(填化学式)MnO2.
(5)KMnO4粗晶体中的主要杂质(填化学式)有KCl和CH3COOK,若用硫酸代替图中的冰醋酸,则导致的问题及原因是反应生成K2SO4,而K2SO4在常温下的溶解度也较小,析出后从而导致产品的纯度降低.
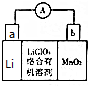 锂及锂盐具有的优异性能和特殊功能,在化工、电子、宇航、核能、能源等领域都得到广泛应用,因此锂元素被誉为“能源元素”.请回答下列问题:
锂及锂盐具有的优异性能和特殊功能,在化工、电子、宇航、核能、能源等领域都得到广泛应用,因此锂元素被誉为“能源元素”.请回答下列问题: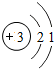 ;
;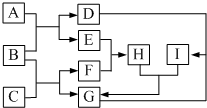 有关物质的转化关系如图所示(部分物质和条件已略去).F是最简单的烃,B是最常见的无色液体,A是一种淡黄色固体,G是一种既能溶于强酸又能溶于强碱的白色固体,C由两种短周期元素组成,其摩尔质量为144g•mol-1.
有关物质的转化关系如图所示(部分物质和条件已略去).F是最简单的烃,B是最常见的无色液体,A是一种淡黄色固体,G是一种既能溶于强酸又能溶于强碱的白色固体,C由两种短周期元素组成,其摩尔质量为144g•mol-1. .
.