题目内容
7.氮的重要化合物如氨(NH3)、肼(N2H4)、三氟化氮(NF3)等,在生产生活中具有重要作用.(1)利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)═H2O(g)△H1=+44.0kJ•mol-1
N2(g)+O2(g)═2NO(g)△H2=+229.3kJ•mol-1
4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H3=-906.5kJ•mol-1
4NH3(g)+6NO(g)═5N2(g)+6H2O(l)△H4
则△H4=-2317kJ•mol-1.
(2)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体.
①写出该反应的离子方程式:2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O.
②在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝.若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图1所示,则N2H4发生分解反应的化学方程式为:3N2H4$?_{△}^{催化剂}$N2+4NH3;为抑制肼的分解,可采取的合理措施有降低反应温度、增加压强等(任写一种).
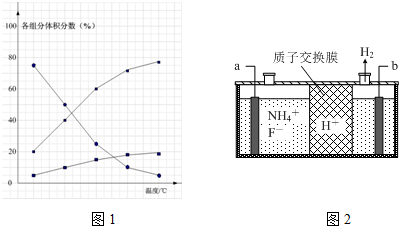
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图2所示.
①氮化硅的化学式为Si3N4.
②a电极为电解池的阳(填“阴”或“阳”)极,写出该电极的电极反应式:NH4++3F--6e-=NF3+4H+;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是F2.
分析 (1)H2O(l)=H2O(g)△H1=44.0kJ•mol-1 (i)
N2(g)+O2(g)=2NO(g)△H2=229.3kJ•mol-1 (ii)
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3=-906.5kJ•mol-1 (iii)
由盖斯定律可知(iii)-(ii)×5-(i)×6得:4NH3(g)+6NO(g)=5N2(g)+6H2O(l);
(2)①依据题意,反应物为Co2+与肼(N2H4)、碱性条件下存在OH-,生成物为:钴单质,据此得出Co的化合价降低,故N的化合价升高,只能为0价,即氮气,依据氧化还原反应得失电子守恒回答即可;
②使湿润的红色石蕊试纸变蓝的气体为氨气,由图1得知:温度越高,肼的百分含量越低,即分解的越快;
(3)①氮化硅中N的非金属性强于Si,Si显+4价,故N显-3价,据此书写化学式;
②由图2可知,氢离子在b极得到电子生成氢气,故b为阴极,那么a为阳极,据此解答即可.
解答 解:(1)H2O(l)=H2O(g)△H1=44.0kJ•mol-1 (i)
N2(g)+O2(g)=2NO(g)△H2=229.3kJ•mol-1 (ii)
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3=-906.5kJ•mol-1 (iii)
(iii)-(ii)×5-(i)×6得:4NH3(g)+6NO(g)=5N2(g)+6H2O(l),故△H4=-906.5-(229.3×5)-(44×6)=-2317kJ•mol-1,
故答案为:-2317;
(2)①依据题意,反应物为Co2+与肼(N2H4)、碱性条件下存在OH-,生成物为:钴单质,据此得出Co的化合价降低,故N的化合价升高,只能为0价,即氮气,据此得出还有水生成,氧化还原反应中存在得失电子守恒以及元素守恒,故此反应的离子反应方程式为:2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O,
故答案为:2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O;
②使湿润的红色石蕊试纸变蓝的气体为氨气,即肼分解生成氨气,依据元素守恒得知另外一种产物为氮气,故化学反应方程式为:3N2H4$?_{△}^{催化剂}$N2+4NH3,由图1可知,温度越高,肼的体积分数含量越低,故要抑制肼的分解,应降低反应温度、增加压强等,
故答案为:3N2H4$?_{△}^{催化剂}$N2+4NH3;降低反应温度、增加压强等;
(3)①氮化硅中N的非金属性强于Si,Si显+4价,故N显-3价,故氮化硅的化学式为:Si3N4,
故答案为:Si3N4;
②由图2可知,氢离子在b极得到电子生成氢气,故b为阴极,那么a为阳极,阳极上铵根失去电子生成NF3,电极反应方程式为:NH4++3F--6e-=NF3+4H+,依据电解原理可知,氟离子也可能失去电子生成氟单质,故氧化性较强的单质为氟气,
故答案为:阳;NH4++3F--6e-=NF3+4H+;F2.
点评 本题主要考查的是盖斯定律的应用、氧化还原反应方程式书写、电解池反应原理等,综合性较强,题目难度中等,注意整理归纳.

| A. | 汽车尾气的排放是造成温室效应的主要原因 | |
| B. | 碘是人体必需的微量元素,但食用过量也会引起甲亢 | |
| C. | 纤维素在人体内可水解成葡萄糖,供人体组织的营养需要 | |
| D. | 明矾是常用的水处理剂,可用于城市自来水的杀菌消毒 |

下列说法正确的是( )
| A. | 丙中一定含有羧基 | B. | 甲不可以与HBr发生取代反应 | ||
| C. | 甲、乙、丙都能发生氧化反应 | D. | 可以用溴水检验乙中的碳碳双键 |
| A. | 原子半径:X<Y<W<Z | |
| B. | 由 W与Y组成的分子都是非极性分子 | |
| C. | 由 Z与Y组成的化合物都能与水反应 | |
| D. | X与氢元素组成的化合物的沸点都低于Y与氢元素组成的化合物 |
| A. | 2015年诺贝尔化学奖颁给了研究细胞修复自身DNA机制的三位科学家.DNA属于有机高分子,化学家鲍林(L.Pauling)提出的氢键理论和蛋白质分子的螺旋结构模型,为DNA分子双螺旋结构模型的提出奠定了基础 | |
| B. | 生物炼铜是指铜矿石在细菌作用下可把不溶性的硫化铜转化为可溶性铜盐,使铜的冶炼变得简单 | |
| C. | 埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液、双氧水均可以将病毒氧化而达到消毒的目的 | |
| D. | 扫描隧道显微技术、超分辨荧光显微技术等的发展促进了人类对微观结构的探索,可实现对原子或分子的操控,使科学研究迈入更高的水平层次 |
| A. | 石油的分馏、煤的干馏均是物理变化 | |
| B. | 应当大力实施矿物燃料“脱硫“、脱硝技术”,减少硫的氧化物和氮氧化物的污染 | |
| C. | 近期我国华北地区出现雾霸天气,PM2.5超标.PM2.5仅来自煤的燃烧 | |
| D. | 根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子最大 |

 .
.