题目内容
17.化学与环境保护、工业生产、生活等密切相关.下列说法正确的是( )| A. | 石油的分馏、煤的干馏均是物理变化 | |
| B. | 应当大力实施矿物燃料“脱硫“、脱硝技术”,减少硫的氧化物和氮氧化物的污染 | |
| C. | 近期我国华北地区出现雾霸天气,PM2.5超标.PM2.5仅来自煤的燃烧 | |
| D. | 根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子最大 |
分析 A.分馏与物质沸点有关,煤的干馏为煤隔绝空气条件下发生的复杂物理化学变化;
B.矿物燃料“脱硫“、脱硝技术”,减少N、S的氧化物等环境污染物排放;
C.PM2.5主要来源是化石燃料燃烧、工业生产、汽车尾气排放等;
D.分散质粒子大小为浊液>胶体>溶液.
解答 解:A.石油的分馏是物理变化、煤的干馏是化学变化,故A错误;
B.矿物燃料“脱硫“、脱硝技术”,减少N、S的氧化物等环境污染物排放,则大力实施矿物燃料“脱硫“、脱硝技术”,减少硫的氧化物和氮氧化物的污染,故B正确;
C.PM2.5主要来源是化石燃料燃烧、工业生产、汽车尾气排放等,导致出现雾霸天气,不仅来自煤的燃烧,故C错误;
D.分散质粒子大小为浊液>胶体>溶液,则根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子最大,故D正确;
故选BD.
点评 本题考查物质的性质、用途及化学与生活,为高频考点,把握物质的性质、环境污染物的来源、分散系等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
8.LiAlH4是重要的储氢材料,其组成类似于Na3AlF6.常见的供氢原理如下面两个方程式所示:①2LiAlH4$\frac{\underline{\;\;△\;\;}}{\;}$2LiH+2Al+3H2↑,②LiAlH4+2H2O═LiAlO2+4H2↑.下列说法正确的是( )
| A. | 若反应①中生成3.36 L氢气,则一定有2.7 g铝生成 | |
| B. | 氢化锂也是一种储氢材料,供氢原理为LiH+H2O═LiOH+H2↑ | |
| C. | 生成等质量的氢气,反应①、②转移电子数之比为4:3 | |
| D. | LiAlH4是共价化合物,LiH是离子化合物 |
5.常温下,下列溶液中微粒的物质的量浓度关系一定正确的是( )
| A. | NaHCO3溶液中:c(H+)+c(H2CO3)=2c(CO32-)+c(OH-) | |
| B. | 向0.1 mol•L-1的NH4Cl溶液中通入一定量的NH3后:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| C. | 向CH3COOH溶液中滴加NaOH使pH>7溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 0.3 mol•L-1的 HY溶液与0.3 mol•L-1的NaOH溶液等体积混合后所得pH=9的溶液中:c(OH-)-c(HY)=c(H+)=1×10-9 mol•L-1 |
2.下列分子式表示物质种类最多的是( )
| A. | C4H8 | B. | C5H12O | C. | C5H11Br | D. | 酯C5H10O2 |
9.水的电离平衡曲线如图所示.下列说法正确的是( )
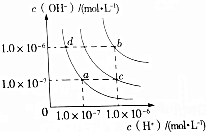

| A. | a点对应温度条件下,将pH=x的氨水稀释10倍后,其pH=y,则x=y+1 | |
| B. | 纯水仅升高温度,可从d点变到b点 | |
| C. | c点对应温度条件下醋酸的电离常数比a点对应温度条件下醋酸的电离常数大 | |
| D. | b点对应温度条件下,0.5mol•L-1的H2SO4溶液与1mol•L-1的KOH溶液等体积混合,充分反应后,所得溶液的c(H+)=10-7mol•L-1 |
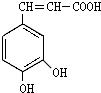 咖啡酸(结构如图)存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别对内脏的止血效果较好.
咖啡酸(结构如图)存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别对内脏的止血效果较好. .
. .
.