题目内容
18.铜及其化合物有着重要的用途,回答下列问题:
(1)写出基态Cu的核外电子排布式1s22s22p63s23p63d104s1,Cu具有良好的导电、导热和延展性,请解释Cu具有导电性的原因Cu为金属晶体,晶体中存在自由移动的电子,通电后定向移动.
(2)CuSO4溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物结构如图1:
①中心原子Cu的杂化形式为sp3,配位数为4;
②元素C、N、O的第一电离能由小到大排列顺序为C<O<N;
③此配合物分解后,可得到CO2,写出二氧化碳的一种等电子体:N2O.
(3)化合物CuMn2O4能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO).
①锰元素在周期表中的位置为第四周期ⅦB族;
②HCHO中含有的σ键和π键数目之比为3:1;
(4)Cu3N具有良好的电学和光学性能,在工业上有重要用途,其晶体结构如图2所示.与同一个N3-相连的Cu+有6个,Cu+的半径为a pm,N3-的半径为b pm,则Cu3N的密度为$\frac{103×1{0}^{30}}{4{N}_{A}(a+b)^{3}}$g•cm-3.(只列式,不用计算出结果)
分析 (1)Cu原子核外电子数为29,根据能量最低原理书写核外电子排布式;Cu为金属晶体,晶体中存在自由移动的电子;
(2)①中心原子Cu的配位数为4,杂化轨道数目为4;
②同周期随原子序数增大,推断第一电离能呈增大起始,N元素原子2p能级为半满稳定状态,第一电离能高于同周期相邻元素的;
③原子数目相等、价电子总数也相等的微粒互为等电子体;
(3)①Mn为25号元素;
②HCHO的结构式为 ,单键为σ键,双键含有1个σ键、1个π键;
,单键为σ键,双键含有1个σ键、1个π键;
(4)晶胞中大黑色球数目为12×$\frac{1}{4}$=3,小黑色球数目为8×$\frac{1}{8}$=1,故大黑色球为Cu+,小黑色球为N3-;
Cu+的半径为a pm,N3-的半径为b pm,则晶胞棱长为2(a+b) pm,结合晶胞中含有原子数目,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算晶体密度.
解答 解:(1)Cu原子核外电子数为29,核外电子排布式为1s22s22p63s23p63d104s1;Cu为金属晶体,晶体中存在自由移动的电子,通电后定向移动,Cu具有良好的导电,
故答案为:1s22s22p63s23p63d104s1;Cu为金属晶体,晶体中存在自由移动的电子,通电后定向移动;
(2)①中心原子Cu与2个N原子、2个O原子之间均形成配位键,的配位数为4,杂化轨道数目为4,采取sp3杂化,
故答案为:sp3;4;
②同周期随原子序数增大,推断第一电离能呈增大起始,N元素原子2p能级为半满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能C<O<N,
故答案为:C<O<N;
③原子数目相等、价电子总数也相等的微粒互为等电子体,二氧化碳的一种等电子体为:N2O等,
故答案为:N2O;
(3)①Mn为25号元素,在周期表中的位置为第四周期ⅦB族,故答案为:第四周期ⅦB族;
②HCHO的结构式为 ,单键为σ键,双键含有1个σ键、1个π键,含有的σ键和π键数目之比为3:1,故答案为:3:1;
,单键为σ键,双键含有1个σ键、1个π键,含有的σ键和π键数目之比为3:1,故答案为:3:1;
(4)晶胞中大黑色球数目为12×$\frac{1}{4}$=3,小黑色球数目为8×$\frac{1}{8}$=1,故大黑色球为Cu+,小黑色球为N3-,补全晶胞结构可知,每个顶点N3-周围有6个Cu+,
晶胞质量为$\frac{(64×3+14)}{{N}_{A}}$g,Cu+的半径为a pm,N3-的半径为b pm,则晶胞棱长为2(a+b) pm,则晶体密度为$\frac{(64×3+14)}{{N}_{A}}$g÷[2(a+b)×10-10 cm]3=$\frac{103×1{0}^{30}}{4{N}_{A}(a+b)^{3}}$g•cm-3,
故答案为:6;$\frac{103×1{0}^{30}}{4{N}_{A}(a+b)^{3}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、杂化方式、配合物、化学键、电离能、晶胞计算等,需要学生具备扎实的基础,注意同周期第一电离能异常情况,掌握均摊法进行晶胞有关计算.

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案| A. | 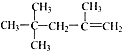 2,2,4-三甲基一4 一戊烯 2,2,4-三甲基一4 一戊烯 | |
| B. |  l,3,4一三甲苯 l,3,4一三甲苯 | |
| C. | CH3CH(CH3)CH(OH)CH3 2-甲基-3-丁醇 | |
| D. |  3,3,4-三甲基己烷 3,3,4-三甲基己烷 |
| A. | “两水”都能与FeCl2溶液反应 | |
| B. | “两水”中都存在可逆反应 | |
| C. | “两水”都有刺激性气味 | |
| D. | “两水”都是混合物,溶液中含有的粒子种类数相同 |
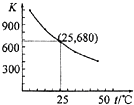 已知:I2在水中溶解度很小,在KI溶液中溶解度显著增大. I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq).测得不同温度下该反应的平衡常数如图所示,下列说法正确的是( )
已知:I2在水中溶解度很小,在KI溶液中溶解度显著增大. I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq).测得不同温度下该反应的平衡常数如图所示,下列说法正确的是( )| A. | 反应I2(aq)+I-(aq)?I3-(aq)的△H>0 | |
| B. | 利用该反应可以除去硫粉中少量的碘单质 | |
| C. | 在上述平衡体系中加入苯,平衡不移动 | |
| D. | 25℃时,在上述平衡体系中加入少量KI固体,平衡常数K小于680 |
| A. | 可能呈酸性 | B. | 不可能呈碱性 | ||
| C. | 可能呈中性或碱性 | D. | 不可能呈中性 |
| A. |  所示装置,蒸干NH4Cl饱和溶液制备NH4Cl晶体 | |
| B. | 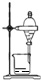 所示装置,分离CCl4萃取I2水后的有机层 | |
| C. | 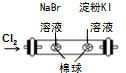 所示装置,证明氧化性:Cl2>Br2>I2 | |
| D. | 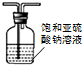 所示装置,除去SO2中混有的少量HCl气体 |
| A. | 若反应①中生成3.36 L氢气,则一定有2.7 g铝生成 | |
| B. | 氢化锂也是一种储氢材料,供氢原理为LiH+H2O═LiOH+H2↑ | |
| C. | 生成等质量的氢气,反应①、②转移电子数之比为4:3 | |
| D. | LiAlH4是共价化合物,LiH是离子化合物 |
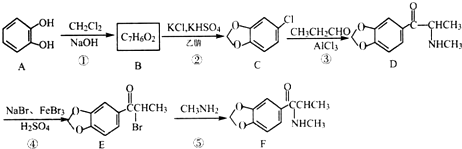
 .
. (填结构简式).
(填结构简式).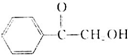 )的合成路线.
)的合成路线.