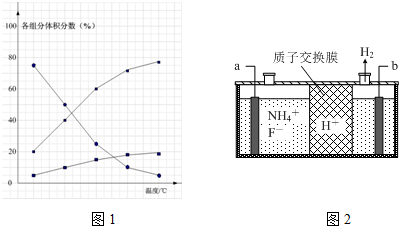
题目内容
15.合理应用和处理氮的化合物,在生产生活中有重要意义.(1)尿素[CO(NH2)2]是一种高效化肥,其分子中各原子的原子半径大小关系为C>N>O>H,碳原子核外有6种运动状态不同的电子.
(2)氰化钠(NaCN)中,N元素显-3价,则非金属性N>C(填“<”、“=”或“>”),写出氰化钠的电子式
 .
.(3)氰化钠属于剧毒物质,可用双氧水或硫代硫酸钠处理.
①用双氧水处理,发生的反应为:NaCN+H2O2+H2O→A+NH3↑,则A的化学式为NaHCO3
②NaCN与Na2S2O3二者等物质的量反应可得到两种含硫元素的离子,其中一种遇到Fe3+显血红色.写出该反应的离子方程式S2O32-+CN-=SCN-+SO32-.
(4)NO2会污染环境,可用Na2CO3溶液吸收NO2并放出CO2.已知9.2g NO2和Na2CO3溶液完全反应时转移电子0.1mol,此反应的离子方程式是2NO2+CO32-=CO2+NO2-+NO3-;恰好反应后,所得溶液呈弱碱性,则溶液中各离子浓度大小关系是c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+).
分析 (1)电子层越多,半径越大;同周期,原子序数大的原子半径小;原子核外没有两个运动状态完全相同的电子,有几个电子就有几种运动状态;
(2)非金属性强的元素显示负价,非金属性弱的则显示正价;NaCN属于离子化合物,钠离子直接用离子符号表示,阴离子需要标出所带电荷及最外层电子;
(3)①根据质量守恒定律来分析A的化学式;②氰化钠中毒,可用Na2S2O3缓解,二者反应得到两种含硫元素的离子,其中一种遇到Fe3+可变为血红色,即反应生成SCN-、SO32-;
(4)若每2mol NO2和Na2CO3溶液反应时转移电子1mol计算生成的硝酸,根据化合价的变化判断生成物,以此书写反应的离子方程式,在碱性溶液中应生成NaNO3和NaNO2,二者浓度相等,NO2-水解溶液呈碱性.
解答 解:(1)CO(NH2)2分子中含有C、N、O、H四种元素,电子层数分别为2、2、2、1,所以H原子半径最小,C、N、O属于同周期,同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径C>N>O>H,碳原子核外有6个电子,所以有6种不同运动状态的电子,
故答案为:C>N>O>H;6;
(2)CN-中N元素显-3价,C元素显+2价,说明N非金属性强,NaCN为离子化合物,电子式为 ,
,
故答案为:>; ;
;
(3)(1)①由反应NaCN+H2O2+H2O═A+NH3↑,根据质量守恒定律可知,元素守恒、原子守恒,则A的化学式为NaHCO3,
故答案为:NaHCO3;
②氰化钠中毒,可用Na2S2O3缓解,二者反应得到两种含硫元素的离子,其中一种遇到Fe3+可变为血红色,即反应生成SCN-、SO32-,离子反应为S2O32-+CN-═SCN-+SO32-,
故答案为:S2O32-+CN-=SCN-+SO32-;
(4)9.2g NO2的物质的量为,每2molNO2和Na2CO3溶液反应时转移电子1mol,则N的化合价分别有+4价变化为+5价和+3价,在碱性溶液中应生成NO3-和NO2-,反应的离子方程式为:2NO2+CO32-=NO3-+NO2-+CO2,若生成的CO2完全逸出,NO2-水解成碱性,所得溶液中的离子浓度大小关系为c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+),
故答案为:2NO2+CO32-=NO3-+NO2-+CO2;c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+).
点评 本题考查原子半径大小关系、非金属性比较、电子式书写、离子浓度大小比较等,是对学生综合能力的考查,题目难度中等.

| A. | 研制水溶剂涂料替代有机溶剂涂料 | |
| B. | 用可降解塑料生产包装盒或快餐盒 | |
| C. | 用反应:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O 制备硫酸铜 | |
| D. |  +CH2=CH2→ +CH2=CH2→ |
| A. | 可能呈酸性 | B. | 不可能呈碱性 | ||
| C. | 可能呈中性或碱性 | D. | 不可能呈中性 |
| A. |  所示装置,蒸干NH4Cl饱和溶液制备NH4Cl晶体 | |
| B. | 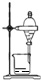 所示装置,分离CCl4萃取I2水后的有机层 | |
| C. | 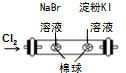 所示装置,证明氧化性:Cl2>Br2>I2 | |
| D. | 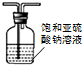 所示装置,除去SO2中混有的少量HCl气体 |
| A | B | C | D | |
| 污染 | 废旧热固性塑料 | 煤燃烧 | 含Hg2+的工业废水 | 生活垃圾 |
| 方法 | 粉碎作为填充剂 | 煤中加入适量石灰石 | 加入Na2S溶液 | 焚烧发电 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 容量瓶、量筒和滴定管上都标有使用温度,容量瓶无“0”刻度,量筒、滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| B. | 向3支试管中各加入2mL 0.1mol•L-1酸性高锰酸钾溶液和2mL 0.01mol•L-1 H2C2O4溶液,将它们分别置于冰水、室温下、80℃热水中,观察比较褪色快慢 | |
| C. | 皂化反应结束后的混合液中加入饱和食盐水,再通过分液操作分离出硬脂酸钠 | |
| D. | 为保证实验安全,金属钠切割下来的表层物质应放回原试剂瓶,不能在研钵中研磨氯酸钾或硝酸钾 |
| A. | NaHCO3溶液中:c(H+)+c(H2CO3)=2c(CO32-)+c(OH-) | |
| B. | 向0.1 mol•L-1的NH4Cl溶液中通入一定量的NH3后:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| C. | 向CH3COOH溶液中滴加NaOH使pH>7溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 0.3 mol•L-1的 HY溶液与0.3 mol•L-1的NaOH溶液等体积混合后所得pH=9的溶液中:c(OH-)-c(HY)=c(H+)=1×10-9 mol•L-1 |
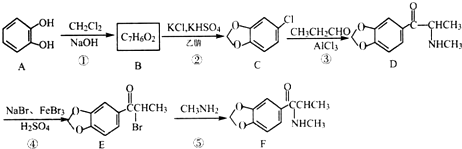
 .
. (填结构简式).
(填结构简式).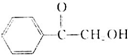 )的合成路线.
)的合成路线.