题目内容
 乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,可由电石(CaC2)直接水化法或甲烷在1500℃左右气相裂解法生产.
乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,可由电石(CaC2)直接水化法或甲烷在1500℃左右气相裂解法生产.(l)电石水化法制乙炔是将生石灰与焦炭在3000℃下反应生成CaC2,CaC2再与水反应即得到乙炔.CaC2与水反应的化学方程式为
(2)已知:CH4(g)+2O2(g)=CO2 (g)+2H2O(l)△H1=-890.3kJ/mol
C2H2(g)+2.5O2(g)=2CO2 (g)+H2O(l)△H2=-1299.6kJ/mol
2H2 (g)+O2(g)=2H2O(l)△H3=-571.6kJ/mol
则甲烷气相裂解反应:2CH4(g)=C2H2(g)+3H2(g) 的△H=
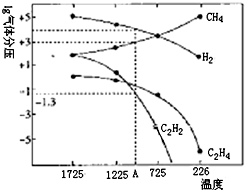
(3)哈斯特研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)昀关系如图所示.
①T1℃时,向1L恒容密闭容器中充入0.3molCH4 只发生反应2CH4(g)=C2H4(g)+2H2(g),达到平衡时,测得
c(C2H4)=c(CH4).该反应的△H
②列式计算反应2CH4(g)=C2H2(g)+3H2(g),在图中A点温度时的平衡常数K=
③由图可知,甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有
考点:用盖斯定律进行有关反应热的计算,化学平衡的影响因素
专题:化学反应中的能量变化,化学平衡专题
分析:(1)碳化钙和水反应生成氢氧化钙和乙炔;
(2)根据盖斯定律来分析;
(3)①分解反应绝大多数为吸热反应;设出CH4的转化浓度,然后根据三段式,利用c(C2H4)=c(CH4)来解答;根据改变温度后,CH4的浓度升高来判断温度的变化;表示出变化后的CH4和C2H4的浓度,然后根据c(CH4)=2c(C2H4)来计算;
②根据平衡常数表达式来计算;
③甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,可以充入适量的乙烯.
(2)根据盖斯定律来分析;
(3)①分解反应绝大多数为吸热反应;设出CH4的转化浓度,然后根据三段式,利用c(C2H4)=c(CH4)来解答;根据改变温度后,CH4的浓度升高来判断温度的变化;表示出变化后的CH4和C2H4的浓度,然后根据c(CH4)=2c(C2H4)来计算;
②根据平衡常数表达式来计算;
③甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,可以充入适量的乙烯.
解答:
解:(1)碳化钙和水反应生成氢氧化钙和乙炔,反应的化学方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑,
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;
(2)已知:①CH4(g)+2O2 (g)═CO2(g)+2H2O(l)△H=-890.3kJ?mol-1 .
②C2H2(g)+2.5O2(g)=2CO2 (g)+H2O(l)△H2=-1299.6kJ/mol
③2H2 (g)+O2(g)=2H2O(l)△H3=-571.6kJ/mol,
将①×4-②-③×
可得:2CH4(g)=C2H2(g)+3H2 (g)△H=(-890.3kJ?mol-1 )×4-(-1299.6kJ?mol-1)-(-571.6kJ?mol-1)×
=+376.4kJ/mol,
故答案为:+376.4kJ/mol;
(3)①反应2CH4(g)=C2H4(g)+2H2(g)为分解反应,而分解反应绝大多数为吸热反应,故此反应为吸热反应;
设CH4的转化浓度为Xmol/L,可知:
2CH4(g)=C2H4(g)+2H2(g)
初始浓度:0.3mol/L 0 0
浓度变化:Xmol/L
Xmol/L
平衡浓度:(0.3-X)mol/L
Xmol/L
根据c(C2H4)=c(CH4)可知:0.3-X=
解得X=0.2mol/L;
故CH4的平衡转化率=
×100%=66.7%;
改变温度后,CH4的浓度升高,即平衡左移,即温度应为降低,即T1>T2;
由于CH4以0.01mol/(L?s)的平均速率增多,经ts后再次达到平衡,故在tS的时间内,CH4的浓度变化为0.01tmol/L,根据浓度的该变量之比等于计量数之比,利用三段式来计算:
2CH4(g)=C2H4(g)+2H2(g)
初始浓度:0.1mol/L 0.1mol/L
浓度改变:0.01tmol/L 0.005tmol/L
平衡浓度:(0.1+0.01t)mol/L (0.1-0.005t)mol/L
由于c(CH4)=2c(C2H4),故有:0.1+0.01t=2×(0.1-0.005t)
解得t=5S
故答案为:>;66.7%;>;5;
②根据此反应的平衡常数表达式,将气体的平衡浓度换为平衡分压,即K=
=
=5×104,故答案为:5×104;
③甲烷裂解制乙炔有副产物乙烯生成,充入适量的乙烯,可抑制甲烷向乙烯的转化,从而提高甲烷制乙炔的转化率,故答案为:可以充入适量的乙烯.
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;
(2)已知:①CH4(g)+2O2 (g)═CO2(g)+2H2O(l)△H=-890.3kJ?mol-1 .
②C2H2(g)+2.5O2(g)=2CO2 (g)+H2O(l)△H2=-1299.6kJ/mol
③2H2 (g)+O2(g)=2H2O(l)△H3=-571.6kJ/mol,
将①×4-②-③×
| 3 |
| 2 |
| 3 |
| 2 |
故答案为:+376.4kJ/mol;
(3)①反应2CH4(g)=C2H4(g)+2H2(g)为分解反应,而分解反应绝大多数为吸热反应,故此反应为吸热反应;
设CH4的转化浓度为Xmol/L,可知:
2CH4(g)=C2H4(g)+2H2(g)
初始浓度:0.3mol/L 0 0
浓度变化:Xmol/L
| Xmol/L |
| 2 |
平衡浓度:(0.3-X)mol/L
| Xmol |
| 2 |
根据c(C2H4)=c(CH4)可知:0.3-X=
| X |
| 2 |
解得X=0.2mol/L;
故CH4的平衡转化率=
| 0.2mol/L |
| 0.3mol/L |
改变温度后,CH4的浓度升高,即平衡左移,即温度应为降低,即T1>T2;
由于CH4以0.01mol/(L?s)的平均速率增多,经ts后再次达到平衡,故在tS的时间内,CH4的浓度变化为0.01tmol/L,根据浓度的该变量之比等于计量数之比,利用三段式来计算:
2CH4(g)=C2H4(g)+2H2(g)
初始浓度:0.1mol/L 0.1mol/L
浓度改变:0.01tmol/L 0.005tmol/L
平衡浓度:(0.1+0.01t)mol/L (0.1-0.005t)mol/L
由于c(CH4)=2c(C2H4),故有:0.1+0.01t=2×(0.1-0.005t)
解得t=5S
故答案为:>;66.7%;>;5;
②根据此反应的平衡常数表达式,将气体的平衡浓度换为平衡分压,即K=
| P(C2H2)?P3(H2) |
| P2(CH4) |
| 0.05×(104)3 |
| (103)2 |
③甲烷裂解制乙炔有副产物乙烯生成,充入适量的乙烯,可抑制甲烷向乙烯的转化,从而提高甲烷制乙炔的转化率,故答案为:可以充入适量的乙烯.
点评:本题考查了盖斯定律的应用、化学平衡常数以及利用三段式来计算转化率等内容,综合性较强,难度适中,均属高考高频考点.应注意平时加强训练.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
在室温下,某溶液中由水电离出的H+浓度为1.0×10-13 mol?L-1,则此溶液中一定能大量存在的离子组是( )
| A、Fe3+、NO3-、Cl-、Na+ |
| B、Ca2+、HCO3-、Cl-、K+ |
| C、NH4+、Fe2+、SO42-、NO3- |
| D、Cl-、SO42-、K+、Na+ |
设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A、常温常压下,16 g CH4中含有的原子总数为5NA |
| B、标准状况下,11.2 LCH3OH中含有的共价键数目为2.5NA |
| C、常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1NA |
| D、标准状况下,0.1 mol Cl2被氢氧化钠溶液完全吸收,转移的电子数目为0.2NA |
汽油燃烧产生的汽车尾气中,所含的大气污染物主要是( )
| A、碳的氧化物 |
| B、硫的氧化物 |
| C、氮的氧化物 |
| D、磷的氧化物 |
最近,美国LawrenceLiremore国家实验室(LLNL)的V.LotA.C?S?Yoo和Cynn成功的在40GPa的高压下,用激光器加热到1800K,将CO2转化为具有类似SiO2结构的原子晶体,其硬度比SiO2还大.下列关于CO2的说法不正确的是( )
| A、CO2是一种酸性氧化物 |
| B、碳氧两种元素只能组成CO2 |
| C、干冰的主要成份是CO2 |
| D、固态CO2的密度比气态CO2的密度大 |
下列说法中,正确的是( )
| A、1 mol任何气体的体积都是22.4 L |
| B、2 mol氯化钠固体溶解于1 L水所得盐酸物质的量为2 mol/L |
| C、含有NA个氦原子的氦气在标准状况下的体积约为11.2 L |
| D、32 g O2中含有氧原子数为1.204×1024 |
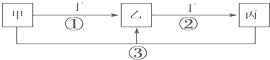 已知甲、乙、丙、丁是中学化学的常见物质,且甲、乙、丙均含有同一种元素.在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去).
已知甲、乙、丙、丁是中学化学的常见物质,且甲、乙、丙均含有同一种元素.在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去). 绿色电源“二甲醚-氧气燃料电池”的工作原理如图,
绿色电源“二甲醚-氧气燃料电池”的工作原理如图,