题目内容
下列说法中,正确的是( )
| A、1 mol任何气体的体积都是22.4 L |
| B、2 mol氯化钠固体溶解于1 L水所得盐酸物质的量为2 mol/L |
| C、含有NA个氦原子的氦气在标准状况下的体积约为11.2 L |
| D、32 g O2中含有氧原子数为1.204×1024 |
考点:物质的量的相关计算
专题:
分析:A.根据影响气体体积的因素进行分析,该选项未指明气体所处的状态;
B.根据配制后溶液的体积进行分析;
C.根据稀有气体属于单原子分子进行判断;
D.根据氧气的物质的量进行计算.
B.根据配制后溶液的体积进行分析;
C.根据稀有气体属于单原子分子进行判断;
D.根据氧气的物质的量进行计算.
解答:
解:A.标况下1mol气体所占体积约是22.4L,未指明气体所处的状态,1mol气体的体积不一定为22.4L,故A错误;
B.2mol氯化钠溶液1L水中,配制的溶液的体积不是1L,所以无法计算溶液的浓度,故B错误;
C.含有NA个氦原子的氦气,物质的量为1mol,标况下体积为22.4L,故C错误;
D.32g氧气的物质的量是n=
=
=1mol,含有2mol氧原子,氧原子数为1.204×1024,故D正确;
故选D.
B.2mol氯化钠溶液1L水中,配制的溶液的体积不是1L,所以无法计算溶液的浓度,故B错误;
C.含有NA个氦原子的氦气,物质的量为1mol,标况下体积为22.4L,故C错误;
D.32g氧气的物质的量是n=
| m |
| M |
| 32g |
| 32g/mol |
故选D.
点评:本题考查了气体摩尔体积及物质的量的计算,需要熟练掌握有关物质的量的常见计算公式应用,本题难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
绿矾(FeSO4?7H2O)的相关性质如下图所示,反应①至⑥均在隔绝空气条件下进行,气体1、2、3的摩尔质量依次增大.

下列推断合理的是( )

下列推断合理的是( )
| A、能发生氧化还原反应的只有①、②、④、⑥ |
| B、将反应①和反应③产生的气体混合,气体颜色发生变化 |
| C、反应⑤生成的固体在空气中高温灼烧只发生分解反应 |
| D、将气体1和气体3冷凝再混合,能计算出所得溶液的物质的量浓度 |
下表是元素周期表的一部分,X、Y、Z、W均为短周期元素,X、Z的质子数之和是2l.下列说法不正确的是( )
| X | Y | ||
| Z | W |
| A、原子半径Z>W>Y |
| B、最高价氧化物对应水化物的酸性Z>W |
| C、氢化物的稳定性X>Z |
| D、X的氢化物与Y的氢化物能发生化合反应生成离子化合物 |
环境问题已成为制约社会发展和进步的严重问题.下列做法或说法不正确的是( )
| A、PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体 |
| B、将煤气化或液化,获得清洁燃料 |
| C、大力发展新能源汽车,如混合动力汽车、电动汽车等,以减少碳、氮氧化物的排放 |
| D、绿色化学的核心是利用化学原理从头上减少和消除工农业生产等对环境的污染 |
下列比较中,正确的是( )
| A、原子半径:Na>Mg |
| B、碱性:NaOH>KOH |
| C、结合H+的能力:CO32-<Cl- |
| D、还原性:I-<Br- |
某一容器中发生如下反应:2NO(g)+O2(g)═2NO2(g);△H=Q kJ?mol-1在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的关系如图所示.下列判断正确的是( )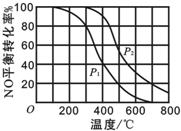

| A、p2>p1且Q<0 |
| B、p2>p1且Q>0 |
| C、p2<p1且Q<0 |
| D、p2<p1且Q>0 |
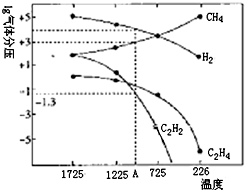 乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,可由电石(CaC2)直接水化法或甲烷在1500℃左右气相裂解法生产.
乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,可由电石(CaC2)直接水化法或甲烷在1500℃左右气相裂解法生产.