题目内容
9.在一定温度下将1mol CO和1mol NO2 充入恒容密闭容器中,反应NO2(g)+CO(g)?CO2(g)+NO(g) 达平衡后,发现有50%CO的转化为CO2,其它条件不变再充入 0.5mol NO2,达到平衡后,CO2的物质的量可能是( )| A. | 0.9 mol | B. | 0.8 mol | C. | 0.6mol | D. | 0.5 mol |
分析 达平衡后,发现有50%CO的转化为CO2,则
NO2(g)+CO(g)?CO2(g)+NO(g)
开始 1 1 0 0
转化 0.5 0.5 0.5 0.5
平衡 0.5 0.5 0.5 0.5
K=1,
其它条件不变再充入 0.5mol NO2,平衡正向移动,CO2的物质的量增大,则
NO2(g)+CO(g)?CO2(g)+NO(g)
开始 1 0.5 0.5 0.5
转化 x x x x
平衡 1-x 0.5-x 0.5+x 0.5+x
$\frac{(0.5+x)^{2}}{(1-x)+(0.5-x)}$=1,解得x=0.1mol.
解答 解:达平衡后,发现有50%CO的转化为CO2,则
NO2(g)+CO(g)?CO2(g)+NO(g)
开始 1 1 0 0
转化 0.5 0.5 0.5 0.5
平衡 0.5 0.5 0.5 0.5
K=$\frac{0.5×0.5}{0.5×0.5}$=1,
其它条件不变再充入 0.5mol NO2,平衡正向移动,CO2的物质的量增大,则
NO2(g)+CO(g)?CO2(g)+NO(g)
开始 1 0.5 0.5 0.5
转化 x x x x
平衡 1-x 0.5-x 0.5+x 0.5+x
$\frac{(0.5+x)^{2}}{(1-x)+(0.5-x)}$=1,解得x=0.1mol,
可知CO2的物质的量为0.5mol+0.1mol=0.6mol,
故选C.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、K的计算为解答的关键,侧重分析与计算能力的考查,注意温度不变、K不变,题目难度不大.

| 选项 | 操作及现象 | 结论 |
| A | 将0.1mol•L-1氨水稀释成0.01mol•L-1,测得pH由11.1变成10.6 | 稀释后NH3•H2O的电离程度减小 |
| B | 将铜片与锌片用导线连接后,插入稀硫酸中,铜片上有气泡产生 | 在锌的作用下,铜与硫酸反应产生氢气 |
| C | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| D | 将固体CaSO4加入Na2CO3饱和溶液中,一段时间后,检验固体成分为CaCO3 | 同温下溶解度:CaSO4<CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 原子核内有8个中子的碳原子${\;}_{8}^{14}$C | |
| B. | 铁红的化学式:FeO | |
| C. | NH4Cl的电子式为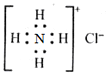 | |
| D. | Ca2+的结构示意图为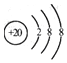 |
| A. | 硫酸与氢氧化钡反应:SO42-+Ba2+═BaSO4↓ | |
| B. | 醋酸滴在锌片上:Zn+2H+=Zn2++H2↑ | |
| C. | 硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+=Fe3++4H2O | |
| D. | 氯化铝溶液中加过量氨水:Al3++3NH3•H2O=Al (OH)3↓+3NH4+ |
| A. | BaCl2 | B. | H2SO4 | C. | AgNO3 | D. | NaOH |


