题目内容
1.下列物质:①盐酸 ②食盐水 ③熔融硝酸钾 ④液态氯化氢 ⑤铜 ⑥氨水 ⑦SO3⑧醋酸 ⑨氢硫酸其中可以导电并且属于强电解质的是③(填所选物质序号,下同)
其中属于强电解质但是不导电的是④.
分析 能导电的物质含有自由电子或自由离子,在水溶液里或熔融状态下能导电的化合物是电解质,能完全电离的电解质是强电解质,据此分析解答.
解答 解:①盐酸、②食盐水、⑥氨水是混合物,所以不是电解质,但都含自由离子所以能导电;
③熔化硝酸钾是强电解质且含有自由移动的离子所以能导电;
④液态氯化氢是强电解质,但没有自由移动的离子,所以不导电;
⑤铜是单质所以不是电解质,但能导电;
⑦三氧化硫是非电解质,不能导电;
⑧醋酸是弱电解质,没有自由离子所以不导电;
⑨氢硫酸是弱电解质,不能导电,
可以导电并且属于强电解质的是③;
其中属于强电解质但是不导电的是④.
故答案为:③;④.
点评 本题考查了能导电的强电解质的判断,题目难度不大,紧扣“强电解质、能导电”来分析解答即可.

练习册系列答案
相关题目
11.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1mol•L-1的NaOH溶液:K+、Ba2+、Cl-、NO3- | |
| B. | 0.1mol•L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl- | |
| C. | 0.1mol•L-1的FeCl3溶液:K+、NH4+、NO3-、Cl- | |
| D. | 0.1mol•L-1的HCl溶液:K+、Na2+、SO42-、CO32- |
9.在一定温度下将1mol CO和1mol NO2 充入恒容密闭容器中,反应NO2(g)+CO(g)?CO2(g)+NO(g) 达平衡后,发现有50%CO的转化为CO2,其它条件不变再充入 0.5mol NO2,达到平衡后,CO2的物质的量可能是( )
| A. | 0.9 mol | B. | 0.8 mol | C. | 0.6mol | D. | 0.5 mol |
16.已知C-C键可以绕键轴自由旋转,结构简式为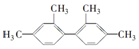 的烃,下列说法中正确的是( )
的烃,下列说法中正确的是( )
 的烃,下列说法中正确的是( )
的烃,下列说法中正确的是( )| A. | 分子中至少有9个碳原子处于同一平面上 | |
| B. | 分子中至少有16个碳原子处于同一平面上 | |
| C. | 分子中至少有10个碳原子处于同一平面上 | |
| D. | 该烃不属苯的同系物 |
10.下列实验事实所得出的结论中,错误的是( )
| A. | 加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定有CO32- | |
| B. | 向AgCl沉淀中滴入稀KI溶液白色沉淀变黄,说明AgI比AgCl更难溶 | |
| C. | 先加入盐酸无沉淀,再加入BaCl2溶液产生白色沉淀,则试样中一定有SO42- | |
| D. | 盐溶液中加入NaOH微热,产生使湿润的红色石蕊试纸变蓝的气体,则一定是铵盐 |
11.草酸是二元中强酸,草酸氢钠溶液显酸性,常温下,向10ml 0.1 mol•L-1NaHC2O4溶液中滴加 0.1mol•L-1NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( )
| A. | V(NaOH)=0时,c(H+)=1×10-2mol•L-1 | |
| B. | V(NaOH)=10mL时,c(H+)=1×10-7mol•L-1 | |
| C. | V(NaOH)>10mL时,c(Na+)>c(C2O42-)>c(HC2O4-) | |
| D. | V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) |
 烟气的主要污染物是SO2、NOx,经臭氧预处理后再用适当溶液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
烟气的主要污染物是SO2、NOx,经臭氧预处理后再用适当溶液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为: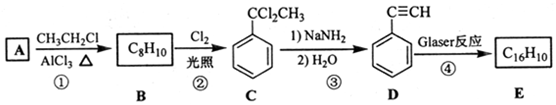
 ,D 的化学名称为苯乙炔.
,D 的化学名称为苯乙炔. .用1mol E合成1,4-二苯基丁烷,理论上需要消耗氢气4mol.
.用1mol E合成1,4-二苯基丁烷,理论上需要消耗氢气4mol.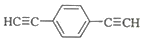 )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为n
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为n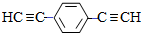 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$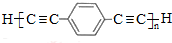 +(n-1)H2.
+(n-1)H2.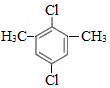 ,
, .
.