题目内容
4.根据下列操作及现象,所得结论正确的是( )| 选项 | 操作及现象 | 结论 |
| A | 将0.1mol•L-1氨水稀释成0.01mol•L-1,测得pH由11.1变成10.6 | 稀释后NH3•H2O的电离程度减小 |
| B | 将铜片与锌片用导线连接后,插入稀硫酸中,铜片上有气泡产生 | 在锌的作用下,铜与硫酸反应产生氢气 |
| C | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| D | 将固体CaSO4加入Na2CO3饱和溶液中,一段时间后,检验固体成分为CaCO3 | 同温下溶解度:CaSO4<CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.NH3•H2O为弱电解质,加水稀释促进电离;
B.构成了原电池,铜为正极,正极上锌失去的电子与氢离子结合生成氢气,而铜不反应;
C.盐类的水解为吸热反应,升高温度促进水解;
D.从难溶电解质的溶解平衡的角度分析.
解答 解:A.NH3•H2O为弱电解质,加水稀释促进电离,由于溶液体积增大,pH反而减小,故A错误;
B.将铜片与锌片用导线连接后,构成了原电池,锌为负极、铜为正极,锌失去的电子从导线转移到铜电极,氢离子在铜电极得到电子生成氢气,该过程铜不参与反应,故B错误;
C.盐类的水解为吸热反应,升高温度促进水解,可根据溶液颜色判断,故C正确;
D.水垢中的CaSO4用Na2CO3溶液充分浸泡后可转化为CaCO3,说明溶解度CaSO4>CaCO3,故D错误;
故选C.
点评 本题考查较为综合,涉及弱电解质、盐类水解以及难溶电解质的溶解平衡等知识,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意相关基本实验操作的注意事项,难度不大,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
14.下列离子方程式书写正确的是( )
| A. | 氯化铝溶液与过量氨水的反应:Al3++3OH-═Al(OH)3↓ | |
| B. | 氯水与碘化钾溶液的反应:Cl2+2I-═2Cl-+I2 | |
| C. | 铁粉与足量稀硫酸的反应:2Fe+3H+═2Fe3++3H2↑ | |
| D. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- |
15.(1)常温常压下,依据事实,写出下列反应的热化学方程式.
①在25℃、101kPa下,2g甲醇燃烧生成CO2和液态水时放热45kJ.则表示甲醇燃烧热的热化学方程式为CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-720kJ/mol.
②若适量的N2和O2完全反应,每生成23g NO2需要吸收17kJ热量N2(g)+2O2(g)═2NO2(g)△H=+68kJ/mol.
(2)断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为KJ•mol-1)表是一些键能数据(KJ•mol-1)
①根据键能数据计算以下反应的反应热△H:
CH4(g)+4F2(g)═CF4(g)+4HF(g)△H
②根据键能和反应热化学方程式$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g )△H=-46kJ•mol-1 计算N≡N的键能.
(3)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(25℃、101kPa下测得的热量).
①该反应的热化学方程式为N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.75kJ/mol.
②又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是408.875 kJ.
①在25℃、101kPa下,2g甲醇燃烧生成CO2和液态水时放热45kJ.则表示甲醇燃烧热的热化学方程式为CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-720kJ/mol.
②若适量的N2和O2完全反应,每生成23g NO2需要吸收17kJ热量N2(g)+2O2(g)═2NO2(g)△H=+68kJ/mol.
(2)断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为KJ•mol-1)表是一些键能数据(KJ•mol-1)
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C-H | 414 | C-F | 489 | H-F | 565 | F-F | 158 |
| H-H | 436 | H-N | 391 |
CH4(g)+4F2(g)═CF4(g)+4HF(g)△H
②根据键能和反应热化学方程式$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g )△H=-46kJ•mol-1 计算N≡N的键能.
(3)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(25℃、101kPa下测得的热量).
①该反应的热化学方程式为N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.75kJ/mol.
②又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是408.875 kJ.
9.在一定温度下将1mol CO和1mol NO2 充入恒容密闭容器中,反应NO2(g)+CO(g)?CO2(g)+NO(g) 达平衡后,发现有50%CO的转化为CO2,其它条件不变再充入 0.5mol NO2,达到平衡后,CO2的物质的量可能是( )
| A. | 0.9 mol | B. | 0.8 mol | C. | 0.6mol | D. | 0.5 mol |
16.已知C-C键可以绕键轴自由旋转,结构简式为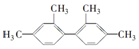 的烃,下列说法中正确的是( )
的烃,下列说法中正确的是( )
 的烃,下列说法中正确的是( )
的烃,下列说法中正确的是( )| A. | 分子中至少有9个碳原子处于同一平面上 | |
| B. | 分子中至少有16个碳原子处于同一平面上 | |
| C. | 分子中至少有10个碳原子处于同一平面上 | |
| D. | 该烃不属苯的同系物 |
14.25℃时,1mol•L-1的NH4Cl、CH3COONH4、NH4HSO4三种溶液中,测得c(NH4+)分别为a、b、c(单位为mol•L-1),下列判断正确的是( )
| A. | a=b=c | B. | a>b>c | C. | a>c>b | D. | c>a>b |
 烟气的主要污染物是SO2、NOx,经臭氧预处理后再用适当溶液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
烟气的主要污染物是SO2、NOx,经臭氧预处理后再用适当溶液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为: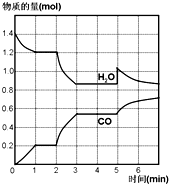 在一容积为2L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)?CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如图所示:
在一容积为2L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)?CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如图所示: