题目内容
18.下列反应的离子方程式正确的是( )| A. | 硫酸与氢氧化钡反应:SO42-+Ba2+═BaSO4↓ | |
| B. | 醋酸滴在锌片上:Zn+2H+=Zn2++H2↑ | |
| C. | 硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+=Fe3++4H2O | |
| D. | 氯化铝溶液中加过量氨水:Al3++3NH3•H2O=Al (OH)3↓+3NH4+ |
分析 A.漏掉氢离子与氢氧根离子的反应;
B.醋酸为弱酸,应保留化学式;
C.得失电子不守恒,电荷不守恒;
D.二者反应生成氢氧化铝沉淀和氯化铵;
解答 解:A.硫酸与氢氧化钡反应,离子方程式:2H++2OH-+SO42-+Ba2+═BaSO4↓+2H2O,故A错误;
B.醋酸滴在锌片上,离子方程式:Zn+2CH3COOH=Zn2++H2↑+2CH3COO-,故B错误;
C.硫酸亚铁溶液中加入过氧化氢溶液,离子方程式:2Fe2++2H2O2+4H+=2Fe3++4H2O,故C错误;
D.氯化铝溶液中加过量氨水,离子方程式:Al3++3NH3•H2O=Al (OH)3↓+3NH4+,故D正确;
故选:D.
点评 本题考查了离子方程式书写,明确反应实质是解题关键,注意离子反应遵循客观事实、遵循原子个数、电荷数守恒规律.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列有关物质的性质或用途的说法中,不正确的是( )
①氯水具有漂白性,可以是湿润有色布条褪色
②可溶性铁盐铝盐可用于净水
③Si-可用与制造光导纤维
④SiO2、Na2CO3和CaCO3可用于制玻璃
⑤水玻璃可用与生产防火材料
⑥铁红常用作红色油漆和涂料.
①氯水具有漂白性,可以是湿润有色布条褪色
②可溶性铁盐铝盐可用于净水
③Si-可用与制造光导纤维
④SiO2、Na2CO3和CaCO3可用于制玻璃
⑤水玻璃可用与生产防火材料
⑥铁红常用作红色油漆和涂料.
| A. | ③⑤ | B. | ④⑤ | C. | ③ | D. | ③④ |
9.在一定温度下将1mol CO和1mol NO2 充入恒容密闭容器中,反应NO2(g)+CO(g)?CO2(g)+NO(g) 达平衡后,发现有50%CO的转化为CO2,其它条件不变再充入 0.5mol NO2,达到平衡后,CO2的物质的量可能是( )
| A. | 0.9 mol | B. | 0.8 mol | C. | 0.6mol | D. | 0.5 mol |
3.下列反应的离子方程式书写正确的是( )
| A. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| B. | 氧化镁与稀盐酸混合:MgO+2H+═Mg2++H2O | |
| C. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| D. | 稀盐酸滴在大理石上:CO32-+2H+═CO2↑+H2O |
10.下列实验事实所得出的结论中,错误的是( )
| A. | 加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定有CO32- | |
| B. | 向AgCl沉淀中滴入稀KI溶液白色沉淀变黄,说明AgI比AgCl更难溶 | |
| C. | 先加入盐酸无沉淀,再加入BaCl2溶液产生白色沉淀,则试样中一定有SO42- | |
| D. | 盐溶液中加入NaOH微热,产生使湿润的红色石蕊试纸变蓝的气体,则一定是铵盐 |
7.下列各组微粒的空间构型相同的是( )
①NH3和H2O
②NH4+和H3O+
③NH3和H3O+
④O3和SO2
⑤CO2和BeCl2.
①NH3和H2O
②NH4+和H3O+
③NH3和H3O+
④O3和SO2
⑤CO2和BeCl2.
| A. | 全部 | B. | ③④⑤ | C. | 除④以外 | D. | ②⑤ |
8.下列说法不正确的是( )
| A. | 焦炭在高温下与水蒸气的反应是吸热反应 | |
| B. | 燃料有足够的空气就能充分燃烧 | |
| C. | 氢氧化钾与硝酸的反应是放热反应 | |
| D. | 化学反应的过程,必定有能量的变化 |
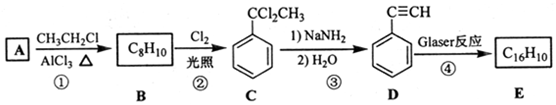
 ,D 的化学名称为苯乙炔.
,D 的化学名称为苯乙炔. .用1mol E合成1,4-二苯基丁烷,理论上需要消耗氢气4mol.
.用1mol E合成1,4-二苯基丁烷,理论上需要消耗氢气4mol.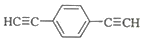 )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为n
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为n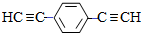 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$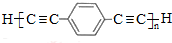 +(n-1)H2.
+(n-1)H2. ,
, .
.