题目内容
12.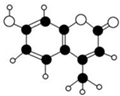 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示.对于该有机物,下列有关叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示.对于该有机物,下列有关叙述正确的是( )| A. | 该物质不能与浓溴水发生取代反应 | |
| B. | 1mol该物质最多能与5mol H2加成 | |
| C. | 该物质能使酸性KMnO4溶液褪色 | |
| D. | 1mol该物质最多能与含2mol NaOH的溶液反应 |
分析 由有机物结构模型可知该有机物的结构简式为 ,含酚-OH、C=C、-COOC-,结合苯酚、烯烃、酯的性质来解答.
,含酚-OH、C=C、-COOC-,结合苯酚、烯烃、酯的性质来解答.
解答 解:该有机物的结构简式为 ,
,
A.含有酚-OH,酚-OH 邻位可与溴水发生取代反应,含碳碳双键与溴水发生加成反应,故A错误;
B.苯环、碳碳双键与氢气发生加成反应,则1mol该物质最多能与4mol H2加成,故B错误;
C.含碳碳双键、酚-OH,均能使酸性高锰酸钾溶液褪色,故C正确;
D.水解产物含有2个酚羟基和1个羧基,则1mol该物质最多能与含3mol NaOH的溶液反应,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团及性质的关系为解答的关键,熟悉苯酚、烯烃的性质即可解答,题目难度不大.

练习册系列答案
相关题目
2.向含有Cu(NO3)2,Zn(NO3)2,Fe(NO3)3,AgNO3各0.1mol 的混合溶液中,加入0.15mol 铁粉,充分搅拌后,产生的变化是( )
| A. | 铁粉溶解,没有任何金属生成 | B. | 铁粉未完全溶解 | ||
| C. | 析出0.1mol 银和0.1mol 铜 | D. | 析出0.1mol 银和0.05mol 铜 |
3.下列各组物质,按氧化物、电解质、非电解质的顺序排列的是( )
| A. | 液氧、稀硫酸、氨气 | B. | 干冰、氢氧化镁、氢氧化铁胶体 | ||
| C. | 冰、氯化钠固体、乙醇 | D. | 生石灰、熟石灰、石灰石 |
20.下列反应中,氧化与还原在同一元素中进行的是( )
| A. | Cl2+2NaOH═NaCl+NaClO+H2O | B. | Fe+CuSO4═FeSO4+Cu | ||
| C. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ | D. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ |
7.下列各组物质中,X是主体物质,Y是少量杂质,Z是要除去杂质而加入的试剂,其中正确的组别是( )
| X | Y | Z | |
| A. | FeCl2溶液 | FeCl3 | KSCN溶液 |
| B. | Al粉 | Fe粉 | NaOH溶液 |
| C. | Fe2(SO4)3溶液 | FeSO4 | Cl2 |
| D. | FeCl2溶液 | CuCl2 | Fe粉 |
| A. | A | B. | B | C. | C | D. | D |
4.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 澄清透明的无色溶液:K+、NH4+、MnO4-、HCO3- | |
| B. | 0.10 mol•L-1 KI溶液:Al3+、Fe3+、Cl-、SO42- | |
| C. | 滴入甲基橙变红色的溶液:Na+、Ca2+、NO3-、Cl- | |
| D. | c(H+)=1×10-12 mol•L-1的溶液:Mg2+、Cu2+、NO3-、SO42- |
1.已知NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温下2.2gCO2中含有共用电子对的数目为2NA | |
| B. | 标准状况下,11.2L苯中含的碳原子数为3NA | |
| C. | 25℃时,0.1mol/L的一元强酸HA中,H+的个数为0.1NA | |
| D. | 6.4gCu与一定浓度的HNO3完全反应得到混合气体,则反应转移的电子数为0.2NA |
2.下列反应的离子方程式中,书写正确的是( )
| A. | 硝酸银溶液跟铜反应 Cu+Ag+=Cu2++Ag | |
| B. | 铁粉跟稀盐酸反应 2Fe+6H+=2Fe3++3H2↑ | |
| C. | 钠跟水反应 2 Na+2H2O=2 Na++2OH-+H2↑ | |
| D. | 碳酸钙跟盐酸反应CO32-+2H+=H2O+CO2↑ |