题目内容
20.下列反应中,氧化与还原在同一元素中进行的是( )| A. | Cl2+2NaOH═NaCl+NaClO+H2O | B. | Fe+CuSO4═FeSO4+Cu | ||
| C. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ | D. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ |
分析 氧化反应与还原反应在同一元素间进行,则反应中只有一种元素的化合价变化,以此来解答.
解答 解:A.反应中只有Cl元素的化合价变化,则氧化反应与还原反应在同一元素间进行,故A选;
B.反应中Fe、Cu元素的化合价变化,氧化反应与还原反应在不同元素之间进行,故B不选;
C.反应中H、O元素的化合价变化,氧化反应与还原反应在不同元素之间进行,故C不选;
D.反应中Cl、O元素的化合价变化,氧化反应与还原反应在不同元素之间进行,故D不选;
故选A.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意元素化合价的判断,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.图分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法中正确的是( )


| A. | 金刚石转变为石墨是吸热反应 | |
| B. | S(g)+O2(g)═SO2(g)△H1,S(s)+O2(g)═SO2(g)△H2,则△H1>△H2 | |
| C. | 白磷比红磷稳定 | |
| D. | CO(g)+H2O(g)═CO2(g)+H2(g)△H<0 |
11.常根据物质的组成、状态、性能等对物质进行分类.下列分类中,前者能够包含后者的是( )
| A. | 酸性氧化物、非金属氧化物 | B. | 胶体、分散系 | ||
| C. | 含氧酸、酸 | D. | 化合物、非电解质 |
8.下列化学用语书写正确的是( )
| A. | 乙酸乙酯的结构简式:CH3CH2COOCH3 | |
| B. | 丙烯的键线式 | |
| C. | 乙醇的结构式: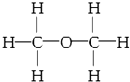 | |
| D. | 乙烯的结构简式:CH2=CH2 |
15.下列关于Na及其化合物的叙述正确的是( )
| A. | 将钠投入FeSO4溶液中,可以得到单质铁 | |
| B. | 将足量的Na2O2和Na2O分别加入酚酞试液中,最终溶液均为红色 | |
| C. | Na2O与Na2O2中阴阳离子的个数比均为1:2 | |
| D. | 在2Na2O2+2H2O=4NaOH+O2反应中,每生成1molO2,消耗2mol氧化剂 |
5.下列关于Na2O2的叙述正确的是( )
| A. | Na2O2是淡黄色固体,久置于空气中变成Na2O | |
| B. | Na2O2与水的反应中,Na2O2只作氧化剂 | |
| C. | 用0.1mol Na2O2与足量水反应转移的电子的物质的量为0.2mol | |
| D. | Na2O2放入饱和NaOH溶液中,放出大量的O2,并有白色固体析出 |
12.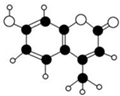 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示.对于该有机物,下列有关叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示.对于该有机物,下列有关叙述正确的是( )
 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示.对于该有机物,下列有关叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示.对于该有机物,下列有关叙述正确的是( )| A. | 该物质不能与浓溴水发生取代反应 | |
| B. | 1mol该物质最多能与5mol H2加成 | |
| C. | 该物质能使酸性KMnO4溶液褪色 | |
| D. | 1mol该物质最多能与含2mol NaOH的溶液反应 |
9.(1)在短周期主族元素中,氯及其相邻两元素的电负性由大到小的顺序是F>Cl>S(用元素符号表示)
(2)A、B、C为同一短周期金属元素.依据下表数据分析,C元素在化合物中的主要化合价为+3;A、B、C三种元素的原子半径由大到小的顺序是A>B>C.
(3)已知过氧化氢分子的空间结构如图所示,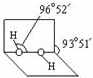 分子中氧原子采取sp3杂化;通常情况下,H2O2与水任意比互溶的主要原因是H2O2分子与水分子间形成氢键,使H2O2与水任意比互溶.
分子中氧原子采取sp3杂化;通常情况下,H2O2与水任意比互溶的主要原因是H2O2分子与水分子间形成氢键,使H2O2与水任意比互溶.
(4)R是1~36号元素中未成对电子数最多的原子.R3+在溶液中存在如下转化:
R3+$?_{H+}^{OH-}$R(OH)3$?_{H+}^{OH-}$[R(OH)4]-
①基态R原子的价电子排布式为3d54s1.
②[R(OH)4]-中存在的化学键是BD.
A.离子键 B.极性键 C.非极性键 D.配位键
(5)等电子体原理可广义理解为:重原子数相等(重原子指原子序数≥4的原子),总电子数或价电子数相等的分子或离子.若将H2O2滴入液氨中,可得白色固体A,红外光谱显示,A中有阴阳两种离子,阳离子是正四面体,阴离子与H2O2互为等电子体.则A的结构简式为NH4OOH.
(2)A、B、C为同一短周期金属元素.依据下表数据分析,C元素在化合物中的主要化合价为+3;A、B、C三种元素的原子半径由大到小的顺序是A>B>C.
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 500 | 4600 | 6900 | 9500 |
| B | 740 | 1500 | 7700 | 10500 |
| C | 580 | 1800 | 2700 | 11600 |
 分子中氧原子采取sp3杂化;通常情况下,H2O2与水任意比互溶的主要原因是H2O2分子与水分子间形成氢键,使H2O2与水任意比互溶.
分子中氧原子采取sp3杂化;通常情况下,H2O2与水任意比互溶的主要原因是H2O2分子与水分子间形成氢键,使H2O2与水任意比互溶.(4)R是1~36号元素中未成对电子数最多的原子.R3+在溶液中存在如下转化:
R3+$?_{H+}^{OH-}$R(OH)3$?_{H+}^{OH-}$[R(OH)4]-
①基态R原子的价电子排布式为3d54s1.
②[R(OH)4]-中存在的化学键是BD.
A.离子键 B.极性键 C.非极性键 D.配位键
(5)等电子体原理可广义理解为:重原子数相等(重原子指原子序数≥4的原子),总电子数或价电子数相等的分子或离子.若将H2O2滴入液氨中,可得白色固体A,红外光谱显示,A中有阴阳两种离子,阳离子是正四面体,阴离子与H2O2互为等电子体.则A的结构简式为NH4OOH.