题目内容
2.向含有Cu(NO3)2,Zn(NO3)2,Fe(NO3)3,AgNO3各0.1mol 的混合溶液中,加入0.15mol 铁粉,充分搅拌后,产生的变化是( )| A. | 铁粉溶解,没有任何金属生成 | B. | 铁粉未完全溶解 | ||
| C. | 析出0.1mol 银和0.1mol 铜 | D. | 析出0.1mol 银和0.05mol 铜 |
分析 根据金属活动顺序表可知氧化性:Zn2+<Cu2+<Ag+,根据金属铜和三价铁反应生成氯化铜和氯化亚铁,可知氧化性Cu2+<Fe3+,所以氧化性的顺序为:Zn2+<Cu2+<Fe3+<Ag+,则加入0.15mol铁粉,先是发生Fe+2Ag+=Ag+Fe2+,消耗0.05mol铁析出0.1mol银和0.05mol二价铁,后发生Fe+2Fe3+=3Fe2+,消耗0.05mol铁生成0.15mol二价铁,余下0.05mol铁和Cu2+反应,消耗0.05mol的铜离子,又生成0.05mol二价铁,据此分析.
解答 解:根据金属活动顺序表可知氧化性:Zn2+<Cu2+<Ag+,根据金属铜和三价铁反应生成氯化铜和氯化亚铁,可知氧化性Cu2+<Fe3+,所以氧化性的顺序为:Zn2+<Cu2+<Fe3+<Ag+,则加入0.15mol铁粉,先是发生Fe+2Ag+=Ag+Fe2+,消耗0.05mol铁析出0.1mol银和0.05mol二价铁,后发生Fe+2Fe3+=3Fe2+,消耗0.05mol铁生成0.15mol二价铁,余下0.05mol铁和Cu2+反应,消耗0.05mol的铜离子,又生成0.05mol二价铁,
A、铁粉溶解,生成0.05mol的铜,故A错误;
B、铁粉完全溶解,故B错误;
C、析出0.1mol 银和0.05mol 铜,故C错误;
D、析出0.1mol 银和0.05mol 铜,故D正确;
故选D.
点评 本题考查学生氧化还原反应中氧化性强弱的判断方法,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
12.下列溶液,在空气中既易被氧化,本身又易分解的是( )
| A. | 苯酚 | B. | H2SO3 | C. | NaHCO3 | D. | HNO3 (浓) |
13.关于浓度均为0.1mol•L-1的三种溶液:①醋酸溶液 ②NaOH溶液 ③醋酸钠溶液,下列说法不正确的是( )
| A. | c(CH3COO-):③>① | |
| B. | 水电离出的c(OH-):②>① | |
| C. | ①和②等体积混合后的溶液:c(OH-)=c(H+)+c(CH3COOH) | |
| D. | ①和③等体积混合后的溶液:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
10.图分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法中正确的是( )


| A. | 金刚石转变为石墨是吸热反应 | |
| B. | S(g)+O2(g)═SO2(g)△H1,S(s)+O2(g)═SO2(g)△H2,则△H1>△H2 | |
| C. | 白磷比红磷稳定 | |
| D. | CO(g)+H2O(g)═CO2(g)+H2(g)△H<0 |
7.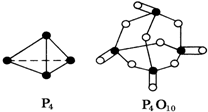 化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.
化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.
(1)下列△H表示物质燃烧热的是△H4、△H5;表示物质中和热的是△H6.(填“△H1”、“△H2”和“△H3”等)
A.2H2(g)+O2(g)=2H2O(l)△H1
B.C(s)+1/2O2(g)=CO(g)△H2
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H3
D.C(s)+O2(g)=CO2(g)△H4
E.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H6
G.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H7
(2)已知在101kPa、273K时,15g乙烷燃烧生成CO2和液态水,放出akJ的热量,下列热化学方程式正确的是C.
A.C2H6(g)+$\frac{7}{2}$O2(g)=2CO2(g)+3H2O(l)△H=+2akJ/mol
B.C2H6(g)+$\frac{7}{2}$/2O2(g)=2CO2(g)+3H2O(g)△H=-2akJ/mol
C.2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)△H=-4akJ/mol
D.2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g)△H=-4akJ/mol
(3)进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关(键能可以简单地理解为断开1mol化学键时所需吸收的能量),如表是部分化学键的键能数据:
已知白磷(P4)的燃烧热为2378.0kJ/mol,白磷完全燃烧的产物(P4O10)的结构如图所示,则如表中a=433.75.
(4)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ/mol.
 化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.
化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.(1)下列△H表示物质燃烧热的是△H4、△H5;表示物质中和热的是△H6.(填“△H1”、“△H2”和“△H3”等)
A.2H2(g)+O2(g)=2H2O(l)△H1
B.C(s)+1/2O2(g)=CO(g)△H2
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H3
D.C(s)+O2(g)=CO2(g)△H4
E.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H6
G.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H7
(2)已知在101kPa、273K时,15g乙烷燃烧生成CO2和液态水,放出akJ的热量,下列热化学方程式正确的是C.
A.C2H6(g)+$\frac{7}{2}$O2(g)=2CO2(g)+3H2O(l)△H=+2akJ/mol
B.C2H6(g)+$\frac{7}{2}$/2O2(g)=2CO2(g)+3H2O(g)△H=-2akJ/mol
C.2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)△H=-4akJ/mol
D.2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g)△H=-4akJ/mol
(3)进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关(键能可以简单地理解为断开1mol化学键时所需吸收的能量),如表是部分化学键的键能数据:
| 化学键 | P-P | P-O | O═O | P═O |
| 键能KJ/mol | 197 | 360 | 499 | a |
(4)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ/mol.
14.研究人员研制出一种可快速充放电的超性能铝离子电池,Al、Cn为电极,有机阳离子与阴离子(AlCl4-、Al2Cl7-)组成的离子液体为电解质.图为该电池放电过程示意图.下列说法错误的是( )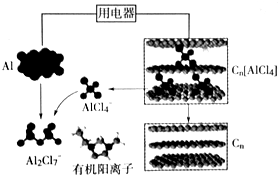

| A. | 充电时,Al做阴极、Cn为阳极 | |
| B. | 充电时,每生成1mol铝,同时消耗4molAl2Cl7- | |
| C. | 放电时,电解质中的有机阳离子向铝电极方向移动 | |
| D. | 放电时,正极反应式为Cn[AlCl4]+e-=Cn+AlCl4- |
11.常根据物质的组成、状态、性能等对物质进行分类.下列分类中,前者能够包含后者的是( )
| A. | 酸性氧化物、非金属氧化物 | B. | 胶体、分散系 | ||
| C. | 含氧酸、酸 | D. | 化合物、非电解质 |
12.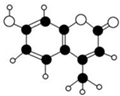 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示.对于该有机物,下列有关叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示.对于该有机物,下列有关叙述正确的是( )
 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示.对于该有机物,下列有关叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示.对于该有机物,下列有关叙述正确的是( )| A. | 该物质不能与浓溴水发生取代反应 | |
| B. | 1mol该物质最多能与5mol H2加成 | |
| C. | 该物质能使酸性KMnO4溶液褪色 | |
| D. | 1mol该物质最多能与含2mol NaOH的溶液反应 |