题目内容
2.下列反应的离子方程式中,书写正确的是( )| A. | 硝酸银溶液跟铜反应 Cu+Ag+=Cu2++Ag | |
| B. | 铁粉跟稀盐酸反应 2Fe+6H+=2Fe3++3H2↑ | |
| C. | 钠跟水反应 2 Na+2H2O=2 Na++2OH-+H2↑ | |
| D. | 碳酸钙跟盐酸反应CO32-+2H+=H2O+CO2↑ |
分析 A.电子、电荷不守恒;
B.反应生成氯化亚铁和氢气;
C.反应生成NaOH和氢气;
D.碳酸钙在离子反应中保留化学式.
解答 解:A.硝酸银溶液跟铜反应的离子反应为Cu+2Ag+=Cu2++2Ag,故A错误;
B.铁粉跟稀盐酸反应的离子反应为Fe+2H+=Fe2++H2↑,故B错误;
C.钠跟水反应的离子反应为2Na+2H2O=2Na++2OH-+H2↑,故C正确;
D.碳酸钙跟盐酸反应的离子反应为CaCO3+2H+=Ca2++H2O+CO2↑,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.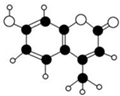 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示.对于该有机物,下列有关叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示.对于该有机物,下列有关叙述正确的是( )
 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示.对于该有机物,下列有关叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示.对于该有机物,下列有关叙述正确的是( )| A. | 该物质不能与浓溴水发生取代反应 | |
| B. | 1mol该物质最多能与5mol H2加成 | |
| C. | 该物质能使酸性KMnO4溶液褪色 | |
| D. | 1mol该物质最多能与含2mol NaOH的溶液反应 |
13.下列比较不正确的是( )
| A. | 酸性:H2SO4>H3PO4 | B. | 碱性:KOH>NaOH | ||
| C. | 原子半径:S<Cl | D. | 稳定性:NH3>CH4 |
7.合金是一类用途广泛的金属材料.下列物质中,不属于合金的是( )
| A. | 黄铜 | B. | 钢 | C. | 水银 | D. | 硬铝 |
14.下列说法正确的是( )
| A. | 合成纤维、人造纤维及碳纤维都属于有机高分子材料 | |
| B. | KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 | |
| C. | SO2、SiO2、CO均为酸性氧化物 | |
| D. | 福尔马林、水玻璃、氨水均为混合物 |
12.美国“海狼”潜艇上的核反应堆内使用了液态铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是( )
| A. | 原子半径:Na>Al | |
| B. | 若把铝钠合金投入一定量的水中只得到无色溶液,则n(Al)≤n(Na) | |
| C. | m g不同组成的铝钠合金投入足量盐酸中,若放出H2越多,则铝的质量分数越小 | |
| D. | 铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀生成 |
 硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物的处理与应用也是科学研究的热点.
硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物的处理与应用也是科学研究的热点.