题目内容
2.下列有关工业生产的叙述中正确的是( )| A. | 硫酸工业中,为了提高SO2的转化率,使用五氧化二钒作催化剂 | |
| B. | 合成氨中通过及时分离液态氨来提高化学反应速率 | |
| C. | 电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小 | |
| D. | 电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室 |
分析 A.催化剂只能改变反应速率,不会引起化学平衡的移动;
B.减小生成物的浓度会导致化学反应速率减慢;
C.电解精炼铜时,在阳极上是金属锌、铁、镍先于金属铜放电;
D.电解饱和食盐水时,在阴极上产生的是氢气和氢氧化钠.
解答 解:A.硫酸工业中,用五氧化二钒作催化剂催化剂,只能加快反应速率,不会引起化学平衡的移动,不会提高SO2的转化率,故A错误;
B.合成氨生产过程中将NH3液化分离,氨气浓度减小会导致化学反应速率减慢,故B错误;
C.电解精炼铜时,在阳极上是金属锌、铁、镍先失去电子,在阴极上是铜离子得电子生成金属Cu的过程,同一时间内阳极溶解铜的质量比阴极析出铜的质量小,故C正确;
D.电解饱和食盐水时,在阴极上产生的是氢气和氢氧化钠,在阳极上产生的是氯气,采用离子交换膜法,可防止阳极室产生的C12进入阴极室,故D错误;
故选C.
点评 本题考查较为综合,涉及硫酸工业、化学反应速率影响、电解精炼铜、氯碱工业等知识,明确常见化工生产原理为解答关键,试题有利于提高学生的灵活应用能力.

练习册系列答案
相关题目
3. 草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的制取、性质及应用,进行如下实验.
草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的制取、性质及应用,进行如下实验.
实验Ⅰ:草酸晶体的制备
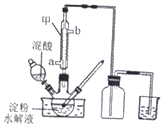
实验室用硝酸氧化淀粉水解液法制备草酸,装罝如图所示:
①一定量的淀粉水解液加入三颈烧瓶中
②控制反应温度55-60℃,边搅拌边缓慢滴加一定量的混合酸
③反应3小时,冷却,抽滤后再重结晶得到草酸晶体.
(1)右图实验装置中仪器甲的名称为冷凝管.冷凝水的进口是a(填“a”或“b”).
(2)检验淀粉是否水解完全所需要的试剂为碘水或I2.
实验Ⅱ:探究草酸与酸性高锰酸钾溶液的反应
(3)向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,可推测草酸可能具有还原性.反应速率开始很慢,后来逐渐加快,可能的原因是生成的硫酸锰或锰离子对反应有催化作用,加快反应速率.写出反应的离子方程式5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
实验Ⅲ:草酸性质的应用
利用比H2C2O4与酸性KMnO4溶液反应探究“条件对化学反应速率的影响.”实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.设计方案如下:
(4)为了观察到紫色褪去,H2C2O4与KMnO4溶液初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥2.5.
(5)探究温度对化学反应速率影响的实验编号是乙和丙,探究反应物浓度对化学反应速率影响的实验编号是甲和乙
实验Ⅳ:草酸晶体中结晶水测定
草酸晶体的化学式可表示为H2C2O4•xH2O,为测定x的值,进行下列实验:
①称取6.3g某草酸晶体配成100.0mL的水溶液.
②取25.00mL所配溶液置于锥形瓶中,加入适量稀H2SO4,用浓度为0.5mol/L的KMnO4溶液滴定,滴定终点时消耗KMnO4的体积为10.00mL.
(6)计算x=2.
 草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的制取、性质及应用,进行如下实验.
草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的制取、性质及应用,进行如下实验.实验Ⅰ:草酸晶体的制备
实验室用硝酸氧化淀粉水解液法制备草酸,装罝如图所示:
①一定量的淀粉水解液加入三颈烧瓶中
②控制反应温度55-60℃,边搅拌边缓慢滴加一定量的混合酸
③反应3小时,冷却,抽滤后再重结晶得到草酸晶体.
(1)右图实验装置中仪器甲的名称为冷凝管.冷凝水的进口是a(填“a”或“b”).
(2)检验淀粉是否水解完全所需要的试剂为碘水或I2.
实验Ⅱ:探究草酸与酸性高锰酸钾溶液的反应
(3)向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,可推测草酸可能具有还原性.反应速率开始很慢,后来逐渐加快,可能的原因是生成的硫酸锰或锰离子对反应有催化作用,加快反应速率.写出反应的离子方程式5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
实验Ⅲ:草酸性质的应用
利用比H2C2O4与酸性KMnO4溶液反应探究“条件对化学反应速率的影响.”实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.设计方案如下:
| 编号 | H2C2O4溶液 | 酸性高锰酸钾溶液 | 温度/℃ | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-l | 体积/mL | ||
| 甲 | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| 乙 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| 丙 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(5)探究温度对化学反应速率影响的实验编号是乙和丙,探究反应物浓度对化学反应速率影响的实验编号是甲和乙
实验Ⅳ:草酸晶体中结晶水测定
草酸晶体的化学式可表示为H2C2O4•xH2O,为测定x的值,进行下列实验:
①称取6.3g某草酸晶体配成100.0mL的水溶液.
②取25.00mL所配溶液置于锥形瓶中,加入适量稀H2SO4,用浓度为0.5mol/L的KMnO4溶液滴定,滴定终点时消耗KMnO4的体积为10.00mL.
(6)计算x=2.
13.等物质的量的下列有机物,在相同条件下完全燃烧,耗氧量最多的是( )
| A. | C5H6 | B. | C4H6 | C. | C4H8O | D. | C5H6O2 |
17.25℃时,用0.100mol/L的盐酸滴定10.00mL0.100mol/L的Na2CO3溶液,滴定曲线如图所示.下列说法正确的是( )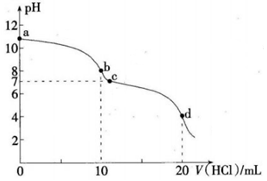

| A. | a、d 两点溶液中水电离出的c(H+):a<d | |
| B. | b点溶液存在:c(CO32-)+c(HCO3-)+c(H2CO3)=0.100mol/L | |
| C. | c点溶液存在:c(Na+)-c(Cl-)=c(HCO3-)+2c(CO32-) | |
| D. | b点溶液加水稀释过程中,溶液的pH不断升高 |
7.下列根据实验操作或现象得出的结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | KBrO3溶液中加入少量苯,然后通入少量Cl2,有机相呈橙色 | 氧化性:Cl2>Br2 |
| B | 室温下,向浓度均为0.1moL•L-1的KCl和KI混合溶液中滴加几滴AgNO3溶液,只出现黄色沉淀 | Ksp(AgI)>Ksp(AgCl) |
| C | 向1mL1%的NaOH溶液中加入2mL2%的CuSO4溶液,振荡后再加入0.5mL有机物Y,加热,未出现砖红色沉淀 | Y中不含有醛基 |
| D | 已知NaAlO2溶液的pH>7,将其蒸干并灼烧得到固体残留物 | 该固体为NaAlO2 |
| A. | A | B. | B | C. | C | D. | D |
14.燃烧氢气时耗氧量小,放出热量多.已知4g H2燃烧生成液态水时放出热量为571.6kJ,表示H2燃烧热的热化学方程式为( )
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol | B. | 2H2(g)+O2(g)═2H2O(g)△H=-571.6kJ/mol | ||
| C. | H2(g)+O2(g)═H2O(l)△H=-285.8 kJ/mol | D. | H2(g)+O2(g)═H2O(g)△H=-285.8 kJ/mol |
11.X、Y、Z、W是原子序数依次增大的三个不同短周期主族元素.X、W均为所在周期数和族序数相等的元素.Y、Z易形成质量比为7:8和7:16的两种常见化合物.下列说法正确的是( )
| A. | 原子半径:Y<Z<W | |
| B. | 原子最外层电子数:W>Z>Y | |
| C. | X、Y可以形成既有极性键也有非极性键的化合物 | |
| D. | 由X、Y、Z三种元素形成的化合物的水溶液一定显酸性 |
12.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 1mol甲基(CH3-)所含的电子数为10NA | |
| B. | 46g由NO2和N2O4组成的混合气体中,含有的原子总数为3NA | |
| C. | 常温常压下,1mol分子式为C2H6O的有机物中,含有C-O键的数目为NA | |
| D. | 标准状次下产22.4L四氯化碳中含有C-Cl键的数目为4NA |