题目内容
8.可逆反应A(g)+2B(g)?2C(g)(正反应为放热反应),在一定条件下达到平衡,若只改变相应条件,请将变化结果 (填“增大”、“减小”或“不变”) 填入相应空格.①升高温度,A的反应速率增大,该反应的平衡常数减小;
②温度不变缩小体积,C的物质的量百分含量增大.
分析 ①该反应放热,升温平衡逆向移动;
②该反应正方向为体积减小的方向,缩小体积,压强增大,平衡正向移动.
解答 解:①该反应放热,升温平衡逆向移动,反应物转化率降低,正逆反应速率增大,已知平衡逆向移动,则平衡常数减小;
故答案为:增大;减小;
②该反应正方向为体积减小的方向,缩小体积,压强增大,平衡正向移动,C的物质的量百分含量增大;
故答案为:增大.
点评 本题考查了化学平衡移动原理的分析判断,注意反应特征和移动原理的分析应用,把握温度、体积对平衡移动的影响,题目较简单.

练习册系列答案
 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
15.某化合物3.2g在氧气中完全燃烧,只生成4.4g CO2和3.6g H2O.下列说法正确的是( )
| A. | 该化合物仅含碳、氢两种元素 | B. | 该化合物中碳、氢原子个数比为1:4 | ||
| C. | 无法确定该化合物是否含有氧元素 | D. | 该化合物中一定不含有氧元素 |
12.下列说法中正确的是( )
| A. | 同时含有分子和离子的电解质溶液,一定是弱电解质溶液 | |
| B. | pH=3的盐酸中,其c(H+)是pH=1的盐酸中的3倍 | |
| C. | 0.1 mol/L KOH溶液和0.1 mol/L 氨水中,其c(OH-)相等 | |
| D. | 室温时,pH=3的硫酸和pH=11的氨水等体积混合,混合溶液的pH>7 |
3.有关化工生产的叙述正确的是( )
| A. | 联碱法对母液的处理方法是向母液中通入二氧化碳,冰冻和加食盐 | |
| B. | 列管式热交换器的使用实现了原料的充分利用 | |
| C. | 焙烧辰砂制取汞的反应原理为:HgS+O2$\stackrel{焙烧}{→}$Hg+SO2 | |
| D. | 氯碱工业、铝的冶炼、牺牲阳极的阴极保护法都是应用了电解池的原理 |
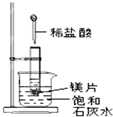 如图所示,把试管放入盛有 25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入 5mL 盐酸于试管中,试回答下列问题:
如图所示,把试管放入盛有 25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入 5mL 盐酸于试管中,试回答下列问题:
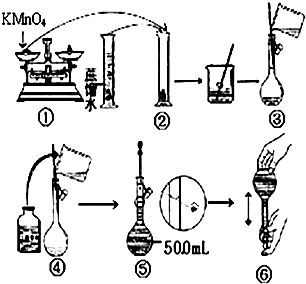 人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:
人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度: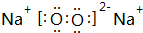 (用电子式表示)
(用电子式表示)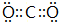 (用电子式表示)
(用电子式表示)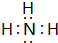 .
.