题目内容
8.(1)工业合成氨与制备HNO3一般可连续生产,其流程如图1: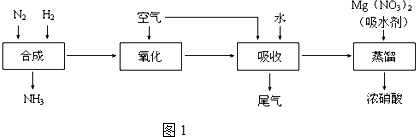
①写出工业合成氨的化学方程式N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,上述尾气中的NO2一定条件下可与氨气反应转化为氮气,则该反应的化学方程式为6NO+4NH3$\frac{\underline{\;一定条件\;}}{\;}$5N2+6H2O.
②某同学在实验室蒸馏含有Mg(NO3)2的稀硝酸制取浓硝酸,除导管、酒精灯、牛角管、锥形瓶外,还需的玻璃仪器有蒸馏烧瓶、温度计、冷凝管.
(2)某兴趣小组采用图2装置制取并探究SO2气体的性质.
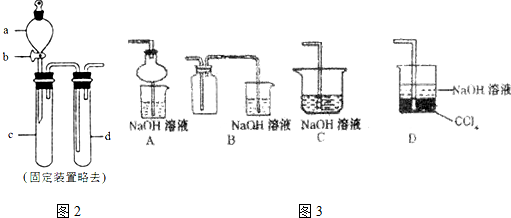
①下列实验方案适用于上图所示装置制取所需SO2的是B(填序号).
A.Na2SO3溶液与HNO3B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧D.铜与浓H2SO4
②组装完仪器后,检查装置气密性的方法是:关闭活塞b,在d的出口处连接一导管并插入水中,用手捂(或酒精灯微热)c,若导管末端有气泡冒出,停止手捂(或加热),导管末端有稳定的水柱,则该装置的气密性良好.
③若要证明c中生成的气体是SO2,d中加入品红溶液后,打开活塞b,反应开始,待d中溶液红色褪去后,再加热(填实验的操作)试管d中的溶液,颜色又恢复,证明气体是SO2.
④指导老师指出应增加一尾气吸收装置,并帮助同学们设计了如图3装置,其中合理的是AD(填序号).
分析 (1)①工业合成氨是氢气和氮气在高温高压催化剂作用下反应生成氨气,NO一定条件下可与氨气反应转化为氮气,结合原子守恒配平书写得到化学方程式;
②依据蒸馏实验过程和实验装置分析需要的玻璃仪器;
(2)①实验室用Na2SO3 固体与浓硫酸反应制备二氧化硫气体;
②检验气密性,在连接好装置之后,可微热装置,观察是否有气泡冒出,并有一段水柱上升;
③根据二氧化硫气体的检验方法分析判断;
④依据尾气成分选择吸收的试剂,装置中需要防止倒吸;
解答 解:(1)①工业合成氨是氢气和氮气在高温高压催化剂作用下反应生成氨气,反应的化学方程式为:N2+3H2 $\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,NO一定条件下可与氨气反应转化为氮气,结合原子守恒配平书写得到化学方程式为:6NO+4NH3$\frac{\underline{\;一定条件\;}}{\;}$5N2+6H2O,
故答案为:N2+3H2 $\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,6NO+4NH3$\frac{\underline{\;一定条件\;}}{\;}$5N2+6H2O;
②某同学在实验室蒸馏含有Mg(NO3)2的稀硝酸制取浓硝酸,除导管、酒精灯、牛角管、锥形瓶外,还需的玻璃仪器有:蒸馏烧瓶、温度计、冷凝管;
故答案为:蒸馏烧瓶、温度计、冷凝管;
(2)①实验室用Na2SO3 固体与浓硫酸反应制备二氧化硫气体,而如图所示装置没有加热,则不能用浓硫酸和铜反应制备,
故答案为:B;
②检验气密性,在连接好装置之后,可微热装置,观察是否有气泡冒出,并有一段水柱上升,具体操作为试管d中加水至浸没长导管口,(塞紧试管c和d的胶塞,)加热c(或用手捂热c),试管d中有气泡冒出,停止加热后,试管d中有一段水柱上升,说明装置气密性良好,
故答案为:关闭活塞b,在d的出口处连接一导管并插入水中,用手捂(或酒精灯微热)c,若导管末端有气泡冒出,停止手捂(或加热),导管末端有稳定的水柱,则该装置的气密性良好;
③若要证明c中生成的气体是SO2,依据二氧化硫能使品红试液褪色,加热恢复红色;d中加入品红溶液后,打开活塞b,反应开始,待d中溶液红色褪去,再加热试管d中的溶液,颜色又恢复,证明气体是SO2,
故答案为:红色褪去; 加热;
④增加一尾气吸收装置防止污染性气体排放到空气中,装置需要很好地吸收气体,又能防止倒吸,BC易发生倒吸,AD可以吸收尾气,也可以防倒吸,
故答案为:AD.
点评 本题考查了氮氧化物、硫及其化合物性质的应用,气体实验制备方法等问题,主要考查二氧化硫的氧化性,还原性,漂白性等性质的实验设计和现象判断,题目难度中等.

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案| A. | 15 种 | B. | 16 种 | C. | 17 种 | D. | 18 种 |
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
则C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3 kJ•mol-1.
②洗涤含SO2的烟气.以下物质可作洗涤剂的是AB.
A.Ca(OH)2 B.Na2CO3 C.CaCl2D.NaHSO3
(3)汽车尾气中有NOx和CO的生成:
①已知气缸中生成NO的反应为:N2(g)+O2(g)═2NO(g)△H>0
ⅰ.若1L空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6.
ⅱ.恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是D
A混合气体的密度不再变化
B混合气体的平均分子量不在变化
C N2、O2、NO的物质的量之比为1:1:2
D氧气的百分含量不在变化
ⅲ.若升高温度,则平衡正向(填“正向”或“逆向”或“不”下同)移动,逆反应速率变大(填“变大”或“变小”或“不变”).
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g).已知该反应的△H>0,则该设想能否实现不能(填“能”或“不能”)?
(4)综上所述,你对该市下一步的环境建设提出的建议是燃煤脱硫;煤气化、液化后再燃烧;冬季供暖烧煤变成烧气;汽车尾气安装催化转换器.
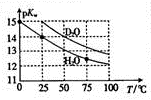 Hz0与D20的pKw (pKw=-lgKw)与温度的关系如图所示,下列有关说法正确的是( )
Hz0与D20的pKw (pKw=-lgKw)与温度的关系如图所示,下列有关说法正确的是( )| A. | D20的电离过程为吸热过程 | B. | 25℃时,纯D20的pH等于7 | ||
| C. | 25℃时,pH=7的液体一定是纯H20 | D. | 常温下,向Dz0中加入DCI,pKw变大 |
| A. | Cl2 | B. | KMnO4 | C. | HCl | D. | FeCl3 |
| A. | 放电时,电池的负极反应为LiC6-e-═Li++C6 | |
| B. | 充电时,电池的正极反应为CoO2+Li++e-═LiCoO2 | |
| C. | 羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质 | |
| D. | 锂离子电池的比能量(单位质量释放的能量)低 |
 Na、Al、Fe、Cu是中学化学中重要的金属元素,它们的单质及其化合物之间有很多转化关系,如通常所说的“铁三角”、“铝三角”等.如表所列物质不能按如图(“→”表示一步完成)关系相互转化的是( )
Na、Al、Fe、Cu是中学化学中重要的金属元素,它们的单质及其化合物之间有很多转化关系,如通常所说的“铁三角”、“铝三角”等.如表所列物质不能按如图(“→”表示一步完成)关系相互转化的是( )| 选项 | A | B | C | D |
| a | NaOH | Al | Fe | Cu |
| b | Na | Al2O3 | FeCl3 | CuSO4 |
| c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | HCO3-的电离方程式:HCO3-+H2O═H2CO3+OH- | |
| D. | Cl2与H2O反应:Cl2+H2O═H++Cl-+HClO |
 如图表示A--E 五种物质的相互转化关系,其中A为淡黄色粉末,C为单质,D为离子化合物.
如图表示A--E 五种物质的相互转化关系,其中A为淡黄色粉末,C为单质,D为离子化合物.