题目内容
20.天津是我国研发和生产锂离子电池的重要基地.锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示.电池反应为CoO2+LiC6$?_{充电}^{放电}$LiCoO2+C6,下列说法正确的是( )| A. | 放电时,电池的负极反应为LiC6-e-═Li++C6 | |
| B. | 充电时,电池的正极反应为CoO2+Li++e-═LiCoO2 | |
| C. | 羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质 | |
| D. | 锂离子电池的比能量(单位质量释放的能量)低 |
分析 放电时,电池的正极发生得电子的还原反应,CoO2+Li++e-=LiCoO2,负极发生失电子的氧化反应,反应为LiC6-e-═Li++C6,充电时,电解池的阴极反应和放电时的负极反应互为逆过程,阳极反应和放电时的正极反应互为逆过程,由电解池的总反应来确定充放电时的电极反应,由于单质锂较活泼,易与羧酸以及醇反应而变质,电解质不能含有羧酸和醇.
解答 解:A、放电时,电池的负极发生失电子的氧化反应,电极反应为LiC6-e-═Li++C6,故A正确;
B、充电时是电解池原理,电池的正极和电源的正极相连,阳极上发生失电子的氧化反应,CoO2+Li++e-═LiCoO2是放电时的正极反应式,故B错误;
C、由于单质锂较活泼,易与醇以及羧酸类物质反应而变质,电解质不能含有醇和羧酸,故C错误.
D、锂离子电池的比能量高,故D错误.
故选A.
点评 本题考查锂电池的组成好工作原理,题目难度不大,本题注意锂电池的组成和工作原理,注意从总电池反应根据化合价的变化判断.

练习册系列答案
相关题目
11.酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:溶解度/(g/100g水)
回答下列问题:
(1)该电池的正极反应式为MnO2+H++e-=MnOOH,电池反应的离子方程式为2MnO2+Zn+2H+=2MnOOH+Zn2+.
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn0.05g.(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过
加热浓缩、冷却结晶分离回收;滤渣的主要成分是MnO2、碳粉和MnOOH,欲从中得到较纯的MnO2,最简便的方法是空气中加热,其原理是碳粉转变为二氧化碳,MnOOH氧化为二氧化锰.
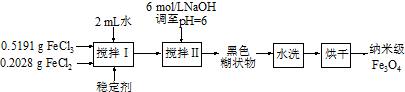
(4)用废电池的锌皮制备ZnSO4•7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为Fe3+,加碱调节至pH为2.7时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为6时,锌开始沉淀(假定Zn2+浓度为0.1mol/L).若上述过程不加H2O2后果是Zn2+和Fe2+分离不开,原因是Zn(OH)2、Fe(OH)2的Ksp相近.
| 温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
(1)该电池的正极反应式为MnO2+H++e-=MnOOH,电池反应的离子方程式为2MnO2+Zn+2H+=2MnOOH+Zn2+.
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn0.05g.(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过
加热浓缩、冷却结晶分离回收;滤渣的主要成分是MnO2、碳粉和MnOOH,欲从中得到较纯的MnO2,最简便的方法是空气中加热,其原理是碳粉转变为二氧化碳,MnOOH氧化为二氧化锰.
(4)用废电池的锌皮制备ZnSO4•7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为Fe3+,加碱调节至pH为2.7时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为6时,锌开始沉淀(假定Zn2+浓度为0.1mol/L).若上述过程不加H2O2后果是Zn2+和Fe2+分离不开,原因是Zn(OH)2、Fe(OH)2的Ksp相近.
15.据报道,以硼氢化合物NaBH4(B元素的化合价为+3)和H2O2作原料的燃料电池可用作空军通信卫星电源,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示.下列说法正确的是( )
| A. | 电池放电时Na+从b极区移向a极区 | |
| B. | 电极b采用MnO2,MnO2既作电极材料又有催化作用 | |
| C. | 每消耗1 mol H2O2,转移的电子为1 mol | |
| D. | 该电池的正极反应为BH4-+8OH--8e-═BO2-+6H2O |
10.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 7.1gCl2与足量的氢氧化钠溶液反应转移的电子数一定为0.2NA | |
| B. | 在常温常压下,11.2 升氯气含有的分子数为0.5NA | |
| C. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA | |
| D. | 1 molFe与足量的Cl2反应转移的电子数为2NA |
 根据物质性质完成下列题型.
根据物质性质完成下列题型.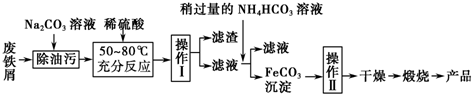
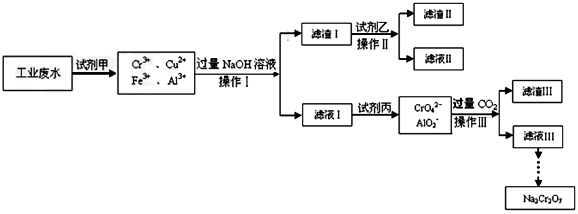
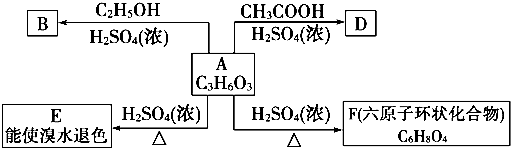
 ;反应类型:消去反应;
;反应类型:消去反应; ;反应类型:酯化反应或取代反应.
;反应类型:酯化反应或取代反应.