题目内容
16.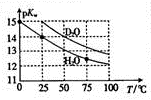 Hz0与D20的pKw (pKw=-lgKw)与温度的关系如图所示,下列有关说法正确的是( )
Hz0与D20的pKw (pKw=-lgKw)与温度的关系如图所示,下列有关说法正确的是( )| A. | D20的电离过程为吸热过程 | B. | 25℃时,纯D20的pH等于7 | ||
| C. | 25℃时,pH=7的液体一定是纯H20 | D. | 常温下,向Dz0中加入DCI,pKw变大 |
分析 由H2O?H++OH-,水中氢离子和氢氧根离子的浓度相等,结合Kw等于氢离子和氢氧根离子浓度之积推断各选项.
A、根据图示:温度越高,pKw越小,所以Kw越大,据此回答;
B、根据25℃时,纯D20的pKw来计算其pH;
C、25℃时,pH=7的液体可以是纯H20、不水解的盐、醋酸铵等物质的溶液;
D、水的离子积只受温度影响,据此回答.
解答 解:A、根据图示:温度越高,pKw越小,所以Kw越大,得到D20的电离过程为吸热过程,故A正确;
B、根据25℃时,纯D20的pKw是15,所以其pH=7.5,故B错误;
C、25℃时,pH=7的液体可以是纯H20、不水解的盐、醋酸铵等物质的溶液,不一定只是纯水,故C错误;
D、水的离子积只受温度影响,常温下,向Dz0中加入DCI,pKw不变,故D错误.
故选A.
点评 本题通过对水的电离平衡常数影响因素、氢离子与氢氧根离子浓度的关系的考查,培养学生分析问题、解决问题的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.柠檬烯是一种食用香精,其结构简式为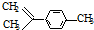 ,有关分析正确的是( )
,有关分析正确的是( )
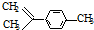 ,有关分析正确的是( )
,有关分析正确的是( )| A. | 一氯代物共有7种 | B. | 分子中所有碳原子一定在同一平面 | ||
| C. | 和 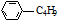 互为同分异构体 互为同分异构体 | D. | 1mol柠檬烯与H2反应最多消耗4mol |
4.实验室常用热的NaOH溶液洗去试管壁上的硫黄,其反应为6NaOH+3S═2Na2S+Na2SO3+3H2O.在此反应中硫表现出的性质是( )
| A. | 氧化性 | B. | 还原性 | ||
| C. | 既无氧化性又无还原性 | D. | 既有氧化性又有还原性 |
11.酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:溶解度/(g/100g水)
回答下列问题:
(1)该电池的正极反应式为MnO2+H++e-=MnOOH,电池反应的离子方程式为2MnO2+Zn+2H+=2MnOOH+Zn2+.
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn0.05g.(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过
加热浓缩、冷却结晶分离回收;滤渣的主要成分是MnO2、碳粉和MnOOH,欲从中得到较纯的MnO2,最简便的方法是空气中加热,其原理是碳粉转变为二氧化碳,MnOOH氧化为二氧化锰.
(4)用废电池的锌皮制备ZnSO4•7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为Fe3+,加碱调节至pH为2.7时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为6时,锌开始沉淀(假定Zn2+浓度为0.1mol/L).若上述过程不加H2O2后果是Zn2+和Fe2+分离不开,原因是Zn(OH)2、Fe(OH)2的Ksp相近.
| 温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
(1)该电池的正极反应式为MnO2+H++e-=MnOOH,电池反应的离子方程式为2MnO2+Zn+2H+=2MnOOH+Zn2+.
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn0.05g.(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过
加热浓缩、冷却结晶分离回收;滤渣的主要成分是MnO2、碳粉和MnOOH,欲从中得到较纯的MnO2,最简便的方法是空气中加热,其原理是碳粉转变为二氧化碳,MnOOH氧化为二氧化锰.
(4)用废电池的锌皮制备ZnSO4•7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为Fe3+,加碱调节至pH为2.7时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为6时,锌开始沉淀(假定Zn2+浓度为0.1mol/L).若上述过程不加H2O2后果是Zn2+和Fe2+分离不开,原因是Zn(OH)2、Fe(OH)2的Ksp相近.
1.Ⅰ.新型材料纳米级Fe粉与普通的还原性能铁粉有很大的差异,纳米级Fe粉表面积大、具有超强的磁性,能用作高密度磁记录的介质以及高效催化剂等.实验室采用气相还原法制备纳米级Fe,其流程如图1: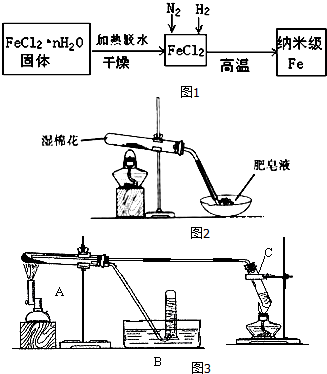
(1)生成纳米级Fe的化学方程式为FeCl2+H2$\frac{\underline{\;高温\;}}{\;}$Fe+2HCl.
(2)纳米级Fe粉在空气中易自燃成黑色固体,但是生活中的铁丝或铁粉在空气中加热也不能燃烧,其原因是纳米级Fe粉与气体接触面大,反应速率快.
(3)FeCl2•nH2O固体加热脱水通常要通入干燥的HCl气流,理由是HCl抑制FeCl2水解,且通入的HCl气体可带走水蒸气.
Ⅱ.查阅资料:在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同:温度低于570℃时生成FeO,高于570℃时生成Fe3O4.
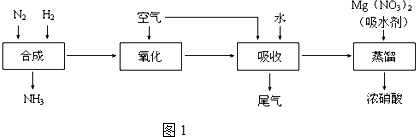
甲同学用如图2所示装置进行纳米级Fe粉与水蒸气的实验:
(4)该装置中纳米级Fe粉与水蒸气反应的化学方程式是Fe+H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$FeO+H2;
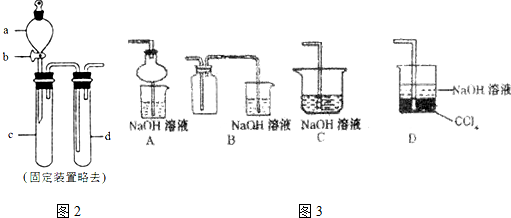
乙同学用如图3所示装置进行纳米级Fe粉与水蒸气的反应并验证产物:
(5)装置C的作用是制取水蒸气.
(6)乙同学为探究实验结束后试管内的固体物质成分,进行了如表实验:
乙同学认为该条件下反应的固体产物为FeO.丙同学认为该结论不正确,他的理由是2Fe3++Fe=3 Fe2+用离子方程式表示).
(7)丁同学称取5.60gFe粉,用乙的装置反应一段时候后,停止加热.将试管内的固体物质在干燥
器中冷却后,称得质量为6.88g.然后将冷却后的固体物质与足量FeCl3溶液充分反应,消耗FeCl3
的0.08mol.丁同学实验的固体产物为Fe3O4.

(1)生成纳米级Fe的化学方程式为FeCl2+H2$\frac{\underline{\;高温\;}}{\;}$Fe+2HCl.
(2)纳米级Fe粉在空气中易自燃成黑色固体,但是生活中的铁丝或铁粉在空气中加热也不能燃烧,其原因是纳米级Fe粉与气体接触面大,反应速率快.
(3)FeCl2•nH2O固体加热脱水通常要通入干燥的HCl气流,理由是HCl抑制FeCl2水解,且通入的HCl气体可带走水蒸气.
Ⅱ.查阅资料:在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同:温度低于570℃时生成FeO,高于570℃时生成Fe3O4.
甲同学用如图2所示装置进行纳米级Fe粉与水蒸气的实验:
(4)该装置中纳米级Fe粉与水蒸气反应的化学方程式是Fe+H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$FeO+H2;
乙同学用如图3所示装置进行纳米级Fe粉与水蒸气的反应并验证产物:
(5)装置C的作用是制取水蒸气.
(6)乙同学为探究实验结束后试管内的固体物质成分,进行了如表实验:
| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 将反应后得到黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
| Ⅱ | 向实验I中得到的溶液滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
(7)丁同学称取5.60gFe粉,用乙的装置反应一段时候后,停止加热.将试管内的固体物质在干燥
器中冷却后,称得质量为6.88g.然后将冷却后的固体物质与足量FeCl3溶液充分反应,消耗FeCl3
的0.08mol.丁同学实验的固体产物为Fe3O4.
 根据物质性质完成下列题型.
根据物质性质完成下列题型.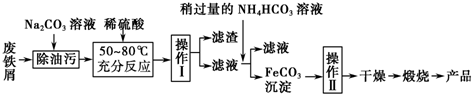
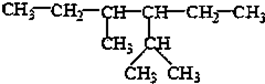 的系统命名为2,4-二甲基-3-乙基乙烷.
的系统命名为2,4-二甲基-3-乙基乙烷.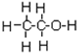 乙烯的电子式
乙烯的电子式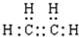
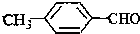 <
<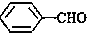
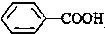 >CH3COOH(提示:类比酚和醇的酸性)
>CH3COOH(提示:类比酚和醇的酸性)