题目内容
14.金属钛(Ti)性能优越,被称为“亲生物金属”.工业上以钛铁矿(主要成分FeTiO3,含FeO、Al2O3、SiO2等杂质)为主要原料冶炼金属钛,其生产的工艺流程图如图: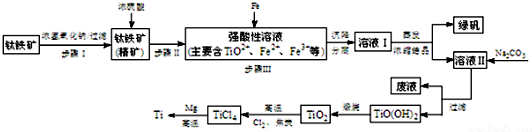
已知:①2H2SO4(浓)+FeTiO3=TiOSO4+FeSO4+2H2O
②TiO2+易水解,只能存在于强酸性溶液中.
(1)步骤I中发生反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O,SiO2+2OH-=SiO32-+H2O.
(2)25℃时,难溶电解质形成沉淀与pH关系如表
| pH | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Ti(OH)2 |
| 开始沉淀 | 1.1 | 4.5 | 7 | 1 |
| 完全沉淀 | 2.8 | 6.4 | 9.2 | 2.7 |
a.步骤II加入铁屑原因是将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀.
b.向溶液II中加入Na2CO3粉末的作用是调节PH,生成TiO(OH)2溶液.溶液Ⅱ中大量含有的阳离子有TiO2+、Fe2+、H+.
(3)TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti.
①写出由TiO2制取TiCl4的化学方程式TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO.
②依据如表信息,需加热的温度略高于1412℃即可.
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
分析 钛铁矿先用浓氢氧化钠溶液溶解,Al2O3、SiO2发生反应,过滤分离,钛铁矿精矿用浓硫酸溶解得到强酸溶液中主要含有TiO2+、Fe2+、Fe3+等,加入过量铁粉还原铁离子,过滤得到滤液通过蒸发浓缩、冷却结晶得到绿矾,过滤得到溶液中主要含有TiO2+、Fe2+、H+等离子,再加入碳酸钠析出TiO(OH)2,加热煅烧得到TiO2,加入氯气、过量碳高温反应生成TiCl4和一氧化碳,四氯化钛和金属镁高温加热反应得到氯化镁和钛金属.
(1)步骤I中氧化铝与氢氧化钠反应生成偏铝酸钠与水,二氧化硅与氢氧化钠反应生成硅酸钠与水;
(2)a.由溶度积可知,步骤II加入铁屑,将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀;
b.溶液Ⅱ中大量含有的阳离子有 TiO2+、Fe2+、H+;
(3)①TiO2与氯气、过量碳高温加热反应生成TiCl4和一氧化碳;
②TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,采用真空蒸馏的方法分离得到Ti,由物质的熔沸点,可知应加热使Mg、MgCl2转化为蒸汽,而Ti不能转化为蒸汽;
(4)根据离子方程式计算25mL溶液中FeSO4的物质的量,再计算2.850g样品中FeSO4•7H2O的质量,进而计算样品中FeSO4•7H2O的质量分数.
解答 解:钛铁矿先用浓氢氧化钠溶液溶解,Al2O3、SiO2发生反应,过滤分离,钛铁矿精矿用浓硫酸溶解得到强酸溶液中主要含有TiO2+、Fe2+、Fe3+等,加入过量铁粉还原铁离子,过滤得到滤液通过蒸发浓缩、冷却结晶得到绿矾,过滤得到溶液中主要含有TiO2+、Fe2+、H+等离子,再加入碳酸钠析出TiO(OH)2,加热煅烧得到TiO2,加入氯气、过量碳高温反应生成TiCl4和一氧化碳,四氯化钛和金属镁高温加热反应得到氯化镁和钛金属.
(1)步骤I中氧化铝与氢氧化钠反应生成偏铝酸钠与水,二氧化硅与氢氧化钠反应生成硅酸钠与水,反应离子方程式为:Al2O3+2OH-=2AlO2-+H2O、SiO2+2OH-=SiO32-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O、SiO2+2OH-=SiO32-+H2O;
(2)a.由溶度积可知,步骤II加入铁屑原因是:将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀,
故答案为:将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀;
b.溶液Ⅱ中大量含有的阳离子有 TiO2+、Fe2+、H+,
故答案为:TiO2+、Fe2+、H+;
(3)①TiO2与氯气、过量碳高温加热反应生成TiCl4和一氧化碳,反应方程式为:TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO,
故答案为:TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO;
②TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,采用真空蒸馏的方法分离得到Ti,由物质的熔沸点,可知应加热使Mg、MgCl2转化为蒸汽,而Ti不能转化为蒸汽,需加热的温度略高于1412℃即可,
故答案为:1412;
(4)由5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,可知25mL溶液中FeSO4的物质的量为5×0.02L×0.01mol/L=0.001mol,则2.850g样品中FeSO4•7H2O的质量为0.001mol×$\frac{250mL}{25mL}$×278g/mol=2.78g,故样品中FeSO4•7H2O的质量分数为$\frac{2.78g}{2.850g}$×100%=97.5%.
故答案为:97.5%.
点评 本题考查物质准备工艺流程,涉及对操作与原理的分析评价、物质的分离提纯、陌生方程式的书写、物质含量测定、对数据的运用用等,侧重考查学生的阅读获取信息、分析解决问题的能力,是对学生综合能力的考查.

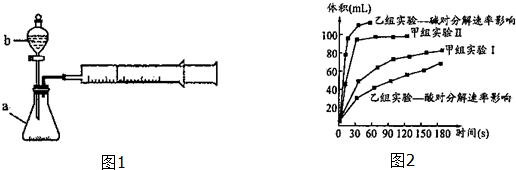
(1)仪器b的名称:分液漏斗.
(2)甲小组有如下实验设计方案,请帮助完成下列填空.
| 实验编号 | 实验目的 | t℃ | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 做实验参照 | 25 | 3滴FeCl3溶液 | 10ml 2%H2O2 |
| 甲组实验Ⅱ | 探究浓度对速率的影响 | 25 | 10ml 5%H2O2 |
①由甲组实验得出的数据可知:浓度越大,H2O2分解速率越快(填“越快”、“越慢”);
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析相同条件下,Na2O2和K2O2溶于水放出气体速率较快的是K2O2;
③乙组提出可以用BaO2固体与H2SO4溶液反应制H2O2,其化学反应方程式为Ba02+H2SO4=H202+BaSO4↓;支持这一方案的理由是制备H202的环境为酸性环境,H202分解速率较慢.
2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑
现用氧化还原滴定法测定草酸晶体的结晶水分子数X,步骤如下:
①用分析天平称取草酸晶体1.440g,将其配制成100.00mL待测草酸溶液
②用移液管移取25.00mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化
③用浓度为0.1000mol•L-1的KMnO4标准溶液进行滴定,三次结果如下:
| 第一次滴定 | 第二次滴定 | 第三次滴定 | |
| 待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
| 标准溶液体积(mL) | 9.99 | 10.01 | 10.00 |
(1)滴定时,KMnO4标准溶液应该装在酸式(填酸式或碱式)滴定管中.
(2)在整个实验过程中,不需要的仪器或用品是④⑥(填序号).
①100mL容量瓶 ②烧杯 ③滴定管夹 ④漏斗 ⑤玻璃棒 ⑥托盘天平
(3)到达滴定终点的标志是加入最后一滴KMnO4溶液,溶液变为浅紫红色,且30s内不褪色.
(4)根据上述数据计算X=3.
(5)若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则X值偏高(填:偏高、偏低、无影响).
(6)若KMnO4标准溶液浓度偏低,则X值偏低(填:偏高、偏低、无影响).
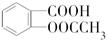 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下: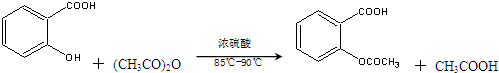
制备基本操作流程如下:
醋酸酐+水杨酸$\stackrel{浓硫酸}{→}$$\stackrel{摇匀}{→}$$\stackrel{85-90℃℃加热}{→}$$\stackrel{冷却}{→}$$→_{洗涤}^{减压过滤}$粗产品
主要试剂和产品的物理常数如下表所示:
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
(1)制备阿司匹林时,要使用干燥的仪器的原因是乙酸酐与水反应.
(2)合成阿司匹林时,最合适的加热方法是水浴加热.
(3)提纯粗产品流程如下,加热回流装置如图:
粗产品$→_{沸石}^{乙酸乙酯}$$→_{回流}^{加热}$$\stackrel{趁热过滤}{→}$$→_{减压过滤}^{冷却}$$→_{干燥}^{洗涤}$乙酰水杨酸
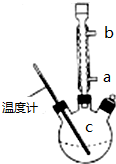
①使用温度计的目的是控制加热的温度,防止乙酰水杨酸受热易分解.
②冷凝水的流进方向是a(填“a”或“b”);
③趁热过滤的原因是防止乙酰水杨酸结晶析出.
④下列说法正确的是abc(填选项字母).
a.此种提纯方法中乙酸乙酯的作用是做溶剂
b.此种提纯粗产品的方法叫重结晶
c.根据以上提纯过程可以得出阿司匹林在乙酸乙酯中的溶解度低温时小
d.可以用紫色石蕊溶液判断产品中是否含有未反应完的水杨酸
(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为84.3%(用百分数表示,小数点后一位).
| A. | 再滴加AgNO3溶液,观察是否有AgI沉淀产生 | |
| B. | 加入CC14振荡后,观察下层液体颜色 | |
| C. | 加入CC14振荡后,取上层清液,滴加AgNO3溶液,观察是否有AgCl沉淀产生 | |
| D. | 加入CC14振荡后,取上层清液,滴加KSCN溶液,观察是否有血红色 |
| A. |  称取氢氧化钠 | B. |  浓硫酸稀释 | C. |  过滤溶液 | D. |  分液操作 |
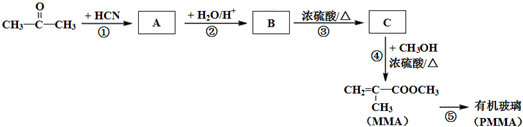
 $\stackrel{+HCN}{→}$
$\stackrel{+HCN}{→}$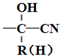
 .
. .
.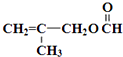
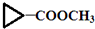
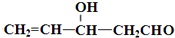
 )”的合成路线(试剂及溶剂任选;合成路线参照“已知”中的书写形式)
)”的合成路线(试剂及溶剂任选;合成路线参照“已知”中的书写形式) .
.
