题目内容
4.下列图示实验操作中,正确的是( )| A. | 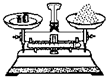 称取氢氧化钠 | B. |  浓硫酸稀释 | C. | 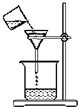 过滤溶液 | D. | 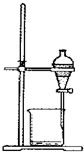 分液操作 |
分析 A.称量时左物右码,且NaOH具有腐蚀性,应在小烧杯中称量;
B.浓硫酸不能在量筒中稀释;
C.过滤需要引流;
D.分层的液体可利用分液漏斗分离.
解答 解:A.称量时左物右码,且NaOH具有腐蚀性,应在小烧杯中称量,则图中药品的位置、操作均不合理,故A错误;
B.浓硫酸不能在量筒中稀释,量筒只能量取液体,应在烧杯中稀释、并用玻璃棒不断搅拌,故B错误;
C.过滤需要引流,则图中缺少玻璃棒,故C错误;
D.分层的液体可利用分液漏斗分离,图中分液装置及操作合理,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握实验基本操作、仪器的使用及混合物分离等为解答的关键,侧重分析与实验能力的考查,注意实验技能及实验装置的作用,题目难度不大.

练习册系列答案
相关题目
14.金属钛(Ti)性能优越,被称为“亲生物金属”.工业上以钛铁矿(主要成分FeTiO3,含FeO、Al2O3、SiO2等杂质)为主要原料冶炼金属钛,其生产的工艺流程图如图:
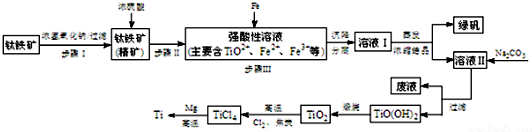
已知:①2H2SO4(浓)+FeTiO3=TiOSO4+FeSO4+2H2O
②TiO2+易水解,只能存在于强酸性溶液中.
(1)步骤I中发生反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O,SiO2+2OH-=SiO32-+H2O.
(2)25℃时,难溶电解质形成沉淀与pH关系如表
TiO(OH)2溶度积Ksp=1×10-29
a.步骤II加入铁屑原因是将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀.
b.向溶液II中加入Na2CO3粉末的作用是调节PH,生成TiO(OH)2溶液.溶液Ⅱ中大量含有的阳离子有TiO2+、Fe2+、H+.
(3)TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti.
①写出由TiO2制取TiCl4的化学方程式TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO.
②依据如表信息,需加热的温度略高于1412℃即可.
(4)为了测定绿矾(FeSO4•7H2O)的含量,称取2.850g绿矾样品配置成250mL溶液,取25.00mL用0.01mol/L酸性KMnO4溶液进行滴定(5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O).消耗KMnO4溶液的体积为20mL计算上述样品中FeSO4•7H2O的质量分数为97.5%.

已知:①2H2SO4(浓)+FeTiO3=TiOSO4+FeSO4+2H2O
②TiO2+易水解,只能存在于强酸性溶液中.
(1)步骤I中发生反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O,SiO2+2OH-=SiO32-+H2O.
(2)25℃时,难溶电解质形成沉淀与pH关系如表
| pH | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Ti(OH)2 |
| 开始沉淀 | 1.1 | 4.5 | 7 | 1 |
| 完全沉淀 | 2.8 | 6.4 | 9.2 | 2.7 |
a.步骤II加入铁屑原因是将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀.
b.向溶液II中加入Na2CO3粉末的作用是调节PH,生成TiO(OH)2溶液.溶液Ⅱ中大量含有的阳离子有TiO2+、Fe2+、H+.
(3)TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti.
①写出由TiO2制取TiCl4的化学方程式TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO.
②依据如表信息,需加热的温度略高于1412℃即可.
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
19.重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:
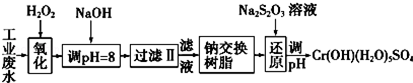
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见表.
(1)氧化过程中可代替H2O2加入的试剂是A(填序号).
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;(填下列选项)已知钠离子交换树脂的原理:Mn++nNaR-→MRn+nNa+,此步操作被交换除去的杂质离子是CD.(填下列选项)
A.Fe3+ B. Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至10-5 mol•L-1.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:

注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见表.
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;(填下列选项)已知钠离子交换树脂的原理:Mn++nNaR-→MRn+nNa+,此步操作被交换除去的杂质离子是CD.(填下列选项)
A.Fe3+ B. Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至10-5 mol•L-1.
9.用下列实验装置进行的实验,能达到目的是( )
| A. |  验证Na与水反应的热效应 | B. |  制氢氧化亚铁 | ||
| C. |  碳酸氢钠受热分解 | D. |  制备少量氧气 |
14.下列操作和所得结论均正确的是( )
| 选项 | 实 验 操 作 | 结 论 |
| A | 用容量瓶配制溶液时,若定容摇匀后液面低于刻度线,补加水至与刻度线相平 | 所配溶液浓度不受影响 |
| B | 用湿润的pH试纸测定氯水的pH | 所测溶液的pH偏大 |
| C | 取少量试液于试管中,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 | 若红色石蕊试纸变蓝 则所取溶液含NH4+ |
| D | 用托盘天平称取一定质量的NaCl固体,左盘放砝码,右盘放固体 | 所称NaCl质量一定偏小 |
| A. | A | B. | B | C. | C | D. | D |