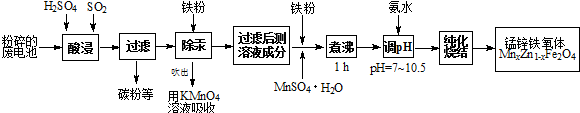
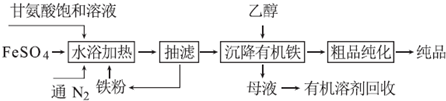
题目内容
19.阿司匹林(乙酰水杨酸,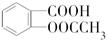 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下: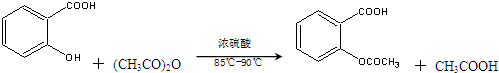
制备基本操作流程如下:
醋酸酐+水杨酸$\stackrel{浓硫酸}{→}$$\stackrel{摇匀}{→}$$\stackrel{85-90℃℃加热}{→}$$\stackrel{冷却}{→}$$→_{洗涤}^{减压过滤}$粗产品
主要试剂和产品的物理常数如下表所示:
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
(1)制备阿司匹林时,要使用干燥的仪器的原因是乙酸酐与水反应.
(2)合成阿司匹林时,最合适的加热方法是水浴加热.
(3)提纯粗产品流程如下,加热回流装置如图:
粗产品$→_{沸石}^{乙酸乙酯}$$→_{回流}^{加热}$$\stackrel{趁热过滤}{→}$$→_{减压过滤}^{冷却}$$→_{干燥}^{洗涤}$乙酰水杨酸
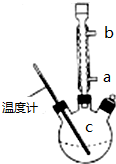
①使用温度计的目的是控制加热的温度,防止乙酰水杨酸受热易分解.
②冷凝水的流进方向是a(填“a”或“b”);
③趁热过滤的原因是防止乙酰水杨酸结晶析出.
④下列说法正确的是abc(填选项字母).
a.此种提纯方法中乙酸乙酯的作用是做溶剂
b.此种提纯粗产品的方法叫重结晶
c.根据以上提纯过程可以得出阿司匹林在乙酸乙酯中的溶解度低温时小
d.可以用紫色石蕊溶液判断产品中是否含有未反应完的水杨酸
(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为84.3%(用百分数表示,小数点后一位).
分析 (1)由于乙酸酐与水反应发生水解反应,制备中仪器应干燥;
(2)控制温度在85℃~90℃,温度低于100℃,应采取水浴加热;
(3)①乙酰水杨酸受热易分解,分解温度为128℃~135℃;
②采取逆流原理通入冷凝水,充满冷凝管,充分冷凝回流;
③防止乙酰水杨酸结晶析出;
④利用水杨酸、乙酰水杨酸在乙酸乙酯中溶解度不同就行分离提纯,水杨酸与乙酰水杨酸均含有羧基,且在水中微弱,不能用紫色石蕊溶液判断产品中是否含有未反应完的水杨酸;
(4)计算水杨酸、乙酸酐的物质的量,进行过量判断,根据不足量的物质计算理论产量,进而计算产率.
解答 解:(1)乙酸酐容易发生水解生成乙酸,故仪器应干燥,防止乙酸酐水解,
故答案为:乙酸酐与水反应;
(2)控制温度在85℃~90℃,温度低于100℃,应采取水浴加热,便于控制温度,防止乙酰水杨酸受热易分解,
故答案为:水浴加热;
(3)①乙酰水杨酸受热易分解,分解温度为128℃~135℃,使用温度计的目的是控制加热的温度,防止乙酰水杨酸受热易分解,
故答案为:乙酰水杨酸受热易分解;
②采取逆流原理通入冷凝水,充满冷凝管,充分冷凝回流,冷凝水从a口进,从b口出,
故答案为:a;
③趁热过滤,防止乙酰水杨酸结晶析出,减少损失,
故答案为:防止乙酰水杨酸结晶析出;
④乙酸乙酯起溶剂作用,趁热过滤除去水杨酸,再冷却结晶析出乙酰水杨酸,说明低温时乙酰水杨酸在乙酸乙酯中的溶解度较小,利用水杨酸、乙酰水杨酸在乙酸乙酯中溶解度不同就行分离提纯,这种分离提纯方法为重结晶,由于水杨酸与乙酰水杨酸均含有羧基,且在水中微弱,不能用紫色石蕊溶液判断产品中是否含有未反应完的水杨酸,
故选:abc;
(4)水杨酸的相对分子质量为138,n(水杨酸)=2.0 g÷138g/mol=0.0145mol,n(乙酸酐)=(5.0 mL×1.08 g/cm3)÷102g/mol=0.0529mol,由于乙酸酐的物质的量大于水杨酸,所以得到的乙酰水杨酸应该按照水杨酸来计算,故理论上得到乙酰水杨酸的质量为0.0145mol×180g/mol=2.61g,所以乙酰水杨酸的产率为(2.2g÷2.61g)×100%=84.3%,
故答案为:84.3%.
点评 本题考查有机物制备实验方案设计与评价,注意对题目信息的应用,(3)中注意根据流程理解分离提纯方法,较好的考查学生分析解决问题的能力,题目难度中等.

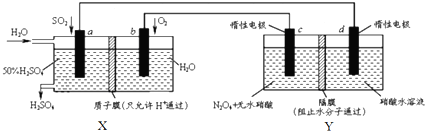
| A. | X是原电池,能够生产硫酸.Y是电解池,能够生产N2O5 | |
| B. | c电极的电极反应方程式为:N2O4+2HNO3-2e-=2N2O5+2H+ | |
| C. | 当电路中通过2mol e-,X、Y中各有1molH+从左边迁移到右边 | |
| D. | 为保证X中硫酸的质量分数不变,则加入的n(so2):n(H2O)=1:7.4 |
| A. | 碳原子间都以单链相连的链烃是烷烃 | |
| B. | 所有糖类物质都有甜味 | |
| C. | 油与脂肪都属于甘油酯 | |
| D. | 葡萄糖与果糖互为同分异构体 |
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol/L | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
| c(S2O${\;}_{8}^{2-}$)/mol/L | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
| t/s | 88.0 | 44.0 | 22.0 | 44.0 | t1 |
(1)该实验的目的是:研究反应物I-与S2O82-的浓度对反应速率的影响.
(2)根据①、②、⑤三个实验的数据,推测显色时间t1=29.3s.
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为A(填字母).
A.<22.0s B.22.0~44.0s C.>44.0s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比.
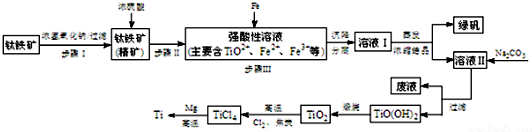
已知:①2H2SO4(浓)+FeTiO3=TiOSO4+FeSO4+2H2O
②TiO2+易水解,只能存在于强酸性溶液中.
(1)步骤I中发生反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O,SiO2+2OH-=SiO32-+H2O.
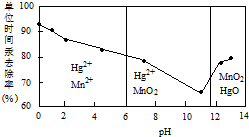
(2)25℃时,难溶电解质形成沉淀与pH关系如表
| pH | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Ti(OH)2 |
| 开始沉淀 | 1.1 | 4.5 | 7 | 1 |
| 完全沉淀 | 2.8 | 6.4 | 9.2 | 2.7 |
a.步骤II加入铁屑原因是将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀.
b.向溶液II中加入Na2CO3粉末的作用是调节PH,生成TiO(OH)2溶液.溶液Ⅱ中大量含有的阳离子有TiO2+、Fe2+、H+.
(3)TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti.
①写出由TiO2制取TiCl4的化学方程式TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO.
②依据如表信息,需加热的温度略高于1412℃即可.
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
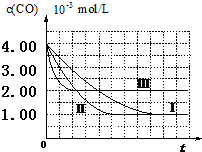 目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
(1)完成以下实验设计表(表中不要留空格).
| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 6.50×10-3 | 120 | |||
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 |
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为3.50×10-3mol/L;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率增大(填“增大”、“减小”、“无影响”).
(II)随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥.而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2?2NH3
(1)在N2+3H2?2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol•L-1.用N2表示其反应速率为0.15mol•L-1•s-1,则所经过的时间为B;
A.2s B.3s C.4s D.6s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是D;
A.v(H2)=0.1mol•L-1•min-1 B.v(N2)=0.1mol•L-1•min-1
C.v(NH3)=0.15mol•L-1•min-1 D.v(N2)=0.002mol•L-1•s-1.
| A. |  验证Na与水反应的热效应 | B. |  制氢氧化亚铁 | ||
| C. |  碳酸氢钠受热分解 | D. |  制备少量氧气 |