题目内容
3.在5ml 0.1mol/L KI溶液中滴加0.1mol/LFeCl3溶液5-6滴后,再进行下列实验,其中可证明FeC13溶液和KI溶液的反应是可逆反应的实验是( )| A. | 再滴加AgNO3溶液,观察是否有AgI沉淀产生 | |
| B. | 加入CC14振荡后,观察下层液体颜色 | |
| C. | 加入CC14振荡后,取上层清液,滴加AgNO3溶液,观察是否有AgCl沉淀产生 | |
| D. | 加入CC14振荡后,取上层清液,滴加KSCN溶液,观察是否有血红色 |
分析 三氯化铁中加过量的碘化钾,充分反应后加硫氰化钾,溶液变血红色,证明有三价铁离子存在,从而证明FeC13溶液和KI溶液的反应,据此进行解答.
解答 解:可逆反应的特点是不能进行彻底,FeCl3中加过量的碘化钾,若仍有三价铁离子存在,则说明该反应为可逆反,所以向充分反应后加硫氰化钾,溶液变血红色,证明有三价铁离子存在,说明该反应为可逆反应,故D正确,
故选D.
点评 本题考查可逆反应特点及应用,题目难度不大,明确铁离子的检验方法为解答关键,注意掌握可逆反应特点,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
4.由物质X合成乙烯雌酚Y的一种路线如下:
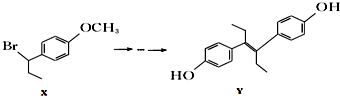
下列叙述正确的是( )

下列叙述正确的是( )
| A. | 化合物x中不含有手性碳原子 | |
| B. | 1mol化合物Y与浓溴水反应,最多消耗5mol Br2 | |
| C. | 在一定条件下化合物Y能发生加聚反应、缩聚反应 | |
| D. | 在氢氧化钠水溶液中加热,化合物X能发生消去反应 |
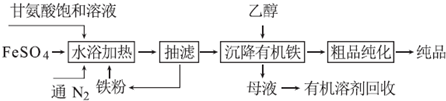
14.金属钛(Ti)性能优越,被称为“亲生物金属”.工业上以钛铁矿(主要成分FeTiO3,含FeO、Al2O3、SiO2等杂质)为主要原料冶炼金属钛,其生产的工艺流程图如图:
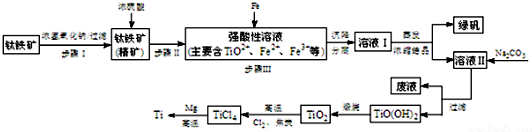
已知:①2H2SO4(浓)+FeTiO3=TiOSO4+FeSO4+2H2O
②TiO2+易水解,只能存在于强酸性溶液中.
(1)步骤I中发生反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O,SiO2+2OH-=SiO32-+H2O.
(2)25℃时,难溶电解质形成沉淀与pH关系如表
TiO(OH)2溶度积Ksp=1×10-29
a.步骤II加入铁屑原因是将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀.
b.向溶液II中加入Na2CO3粉末的作用是调节PH,生成TiO(OH)2溶液.溶液Ⅱ中大量含有的阳离子有TiO2+、Fe2+、H+.
(3)TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti.
①写出由TiO2制取TiCl4的化学方程式TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO.
②依据如表信息,需加热的温度略高于1412℃即可.
(4)为了测定绿矾(FeSO4•7H2O)的含量,称取2.850g绿矾样品配置成250mL溶液,取25.00mL用0.01mol/L酸性KMnO4溶液进行滴定(5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O).消耗KMnO4溶液的体积为20mL计算上述样品中FeSO4•7H2O的质量分数为97.5%.

已知:①2H2SO4(浓)+FeTiO3=TiOSO4+FeSO4+2H2O
②TiO2+易水解,只能存在于强酸性溶液中.
(1)步骤I中发生反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O,SiO2+2OH-=SiO32-+H2O.
(2)25℃时,难溶电解质形成沉淀与pH关系如表
| pH | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Ti(OH)2 |
| 开始沉淀 | 1.1 | 4.5 | 7 | 1 |
| 完全沉淀 | 2.8 | 6.4 | 9.2 | 2.7 |
a.步骤II加入铁屑原因是将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀.
b.向溶液II中加入Na2CO3粉末的作用是调节PH,生成TiO(OH)2溶液.溶液Ⅱ中大量含有的阳离子有TiO2+、Fe2+、H+.
(3)TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti.
①写出由TiO2制取TiCl4的化学方程式TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO.
②依据如表信息,需加热的温度略高于1412℃即可.
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
18.表是稀硫酸与某金属反应的实验数据:
分析上述数据,回答下列问题:
(1)实验4和5表明固体表面积对反应速率有影响;固体表面积越大,反应速率越快,能表明这一规律另一组实验是1和2(填实验序号).
(2)在前4次实验中,能表明反应物浓度对反应速率产生影响的实验有1、3、4(填序号).
(3)本实验中影响反应速率的其他因素还有温度,其实验序号是6和7.
(4)实验中,反应前后溶液的温度变化值(约15℃)相近,推测其原因:反应物用量相同,放出的热量相同.
| 实验 序号 | 金属 质量/g | 金属 状态 | c(H2SO4) /mol•L-1 | V(H2SO4)/mL | 溶液温度/℃ | 金属消失的时间/S | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 20 | 44 | 40 |
(1)实验4和5表明固体表面积对反应速率有影响;固体表面积越大,反应速率越快,能表明这一规律另一组实验是1和2(填实验序号).
(2)在前4次实验中,能表明反应物浓度对反应速率产生影响的实验有1、3、4(填序号).
(3)本实验中影响反应速率的其他因素还有温度,其实验序号是6和7.
(4)实验中,反应前后溶液的温度变化值(约15℃)相近,推测其原因:反应物用量相同,放出的热量相同.
8. 目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
(1)完成以下实验设计表(表中不要留空格).
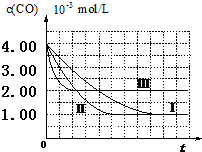
【图象分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图,如图:
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为3.50×10-3mol/L;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率增大(填“增大”、“减小”、“无影响”).
(II)随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥.而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2?2NH3
(1)在N2+3H2?2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol•L-1.用N2表示其反应速率为0.15mol•L-1•s-1,则所经过的时间为B;
A.2s B.3s C.4s D.6s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是D;
A.v(H2)=0.1mol•L-1•min-1 B.v(N2)=0.1mol•L-1•min-1
C.v(NH3)=0.15mol•L-1•min-1 D.v(N2)=0.002mol•L-1•s-1.
 目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
(1)完成以下实验设计表(表中不要留空格).
| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 6.50×10-3 | 120 | |||
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 |
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为3.50×10-3mol/L;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率增大(填“增大”、“减小”、“无影响”).
(II)随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥.而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2?2NH3
(1)在N2+3H2?2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol•L-1.用N2表示其反应速率为0.15mol•L-1•s-1,则所经过的时间为B;
A.2s B.3s C.4s D.6s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是D;
A.v(H2)=0.1mol•L-1•min-1 B.v(N2)=0.1mol•L-1•min-1
C.v(NH3)=0.15mol•L-1•min-1 D.v(N2)=0.002mol•L-1•s-1.