题目内容
某学生利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.
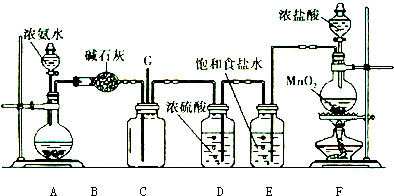
请回答下列问题:
(1)装置F中发生反应的离子方程式为 ;
(2)装置A的烧瓶中可装试剂 ;
(3)B装置的名称是 ;E装置的作用 ;
(4)通入C装置的两根导管左边较长、右边较短,目的是 ;
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一.请写出反应的化学方程式: .当有a mol氯气参加反应时,转移的电子总数为b个,则阿伏伽德罗数常数为(用含a、b的代数式表示) ;
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理? .

请回答下列问题:
(1)装置F中发生反应的离子方程式为
(2)装置A的烧瓶中可装试剂
(3)B装置的名称是
(4)通入C装置的两根导管左边较长、右边较短,目的是
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一.请写出反应的化学方程式:
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?
考点:氯气的化学性质,氨的实验室制法
专题:卤族元素,氮族元素
分析:(1)氯气的实验室制备方法:浓盐酸和二氧化锰在加热条件下发生反应来制取;
(2)将浓氨水滴加到生石灰或固体氢氧化钠上可以产生氨气;
(3)根据干燥管的特点以及氯化氢气体极易溶于饱和食盐水中的知识来回答;
(4)根据氨气和氯气的密度大小以及保证二者充分混合的方法来回答;
(5)过量的氯气可以和氨气之间反应生成氮气和氯化铵,根据公式n=
来计算回答;
(6)氯气是酸性气体,可以和强碱氢氧化钠之间发生反应.
(2)将浓氨水滴加到生石灰或固体氢氧化钠上可以产生氨气;
(3)根据干燥管的特点以及氯化氢气体极易溶于饱和食盐水中的知识来回答;
(4)根据氨气和氯气的密度大小以及保证二者充分混合的方法来回答;
(5)过量的氯气可以和氨气之间反应生成氮气和氯化铵,根据公式n=
| N |
| NA |
(6)氯气是酸性气体,可以和强碱氢氧化钠之间发生反应.
解答:
解:(1)氯气的实验室制备方法:浓盐酸和二氧化锰在加热条件下发生反应来制取,反应的实质是:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
(2)将浓氨水滴加到生石灰或固体氢氧化钠上可以产生氨气,所以装置A的烧瓶中可装试剂是生石灰或固体氢氧化钠,
故答案为:生石灰或固体氢氧化钠;
(3)B装置的名称是干燥管,E装置中的饱和食盐水可以将氯气中的氯化氢吸收,氯气不溶于其中,但是氯化氢在其中的溶解度较大,
故答案为:干燥管;除去氯气中的氯化氢;
(4)氨气密度比氯气的小,通入C装置的两根导管左边较长(导氨气)、右边较短(导氯气),可以保证二者充分混合,
故答案为:使密度大的氯气与密度小的氨气较快地均匀混合;
(5)过量的氯气可以和氨气之间反应生成氮气和氯化铵,即3Cl2+8NH3═N2+6NH4Cl,当有3mol氯气参加反应时,转移的电子为6mol,当有n mol氯气参加反应时,转移的电子为2n mol,个数是N=2n?NA,所以NA=
=
mol-1,
故答案为:
mol-1;
(6)氯气是酸性气体,可以和强碱氢氧化钠之间发生反应,可以用氢氧化钠进行尾气处理,
故答案为:在G连接导管直接通入盛有烧碱的烧杯中.
| ||
故答案为:MnO2+4H++2Cl-
| ||
(2)将浓氨水滴加到生石灰或固体氢氧化钠上可以产生氨气,所以装置A的烧瓶中可装试剂是生石灰或固体氢氧化钠,
故答案为:生石灰或固体氢氧化钠;
(3)B装置的名称是干燥管,E装置中的饱和食盐水可以将氯气中的氯化氢吸收,氯气不溶于其中,但是氯化氢在其中的溶解度较大,
故答案为:干燥管;除去氯气中的氯化氢;
(4)氨气密度比氯气的小,通入C装置的两根导管左边较长(导氨气)、右边较短(导氯气),可以保证二者充分混合,
故答案为:使密度大的氯气与密度小的氨气较快地均匀混合;
(5)过量的氯气可以和氨气之间反应生成氮气和氯化铵,即3Cl2+8NH3═N2+6NH4Cl,当有3mol氯气参加反应时,转移的电子为6mol,当有n mol氯气参加反应时,转移的电子为2n mol,个数是N=2n?NA,所以NA=
| N |
| 2a |
| b |
| 2a |
故答案为:
| b |
| 2a |
(6)氯气是酸性气体,可以和强碱氢氧化钠之间发生反应,可以用氢氧化钠进行尾气处理,
故答案为:在G连接导管直接通入盛有烧碱的烧杯中.
点评:本题考查学生氯气的化学性质以及氨气的实验室制备等方面的知识,属于综合实验考查,难度不大.

练习册系列答案
相关题目
根据右表提供的数据,判断在等物质的量浓度的NaClO和NaHCO3混合溶液中,各种离子浓度关系正确的是( )
| 化学式 | 电离常数 |
| HClO | Ki=3×10-8 |
| H2CO3 | Ki1=4.3×10-7 |
| Ki2=5.6×10-11 |
| A、c(Na+)>c(HCO3-)+c(ClO-)+2c(CO32-) |
| B、c(ClO-)>c(HCO3-)>c(H+) |
| C、c(HClO)+c(ClO-)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| D、c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-) |
下列反应不能用CO3 2-+3H+═CO2↑+H2O来表示的是( )
| A、Na2CO3+HCl |
| B、BaCO3+HCl |
| C、K2CO3+HNO3 |
| D、Na2CO3+H2SO4 |
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等.下列反应与Cl2+SO2+2HzO═H2SO4+2HCl相比较,水的作用不相同的是( )
| A、3NO2+H2O═2HNO3+NO | ||||
| B、2Na2O2+2H2O═4NaOH+O2↑ | ||||
| C、4Fe(OH)2+2H2O+O2═4Fe(OH)3 | ||||
D、3Fe+4H2O
|
下列离子方程式中正确的是( )
| A、AgNO3溶液中加过量的氨水:Ag++NH3?H2O═AgOH↓+NH4+ |
| B、向AgCl悬浊液中滴加硫化钠溶液,白色沉淀变成黑色:2AgCl+S2-═Ag2S+2Cl- |
| C、FeS固体溶于稀HNO3:FeS+2H+═Fe2++H2S↑ |
| D、在NaHSO4溶液中滴加Ba(OH)2至中性:H++SO4-+Ba2++OH-═BaSO4↓+H2O |
下列离子方程式书写不正确的是( )
| A、AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | ||||
B、用铁做电极电解硫酸铜溶液:2Cu2++2H2O
| ||||
| C、碳酸钡溶于醋酸:BaCO3+2H+═Ba2++H2O+CO2↑ | ||||
| D、将氯气通入氯化亚铁溶液:2Fe2++Cl2═2Fe3++2Cl- |
