题目内容
A是短周期元素X组成的常见单质,B、C为中学常见的化合物,且U、C均含有元素X,它们有如图所示的转化关系(部分产物已略去).请回答下列问题
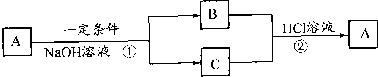
(1)X能否为金属 (填“能”或“不能”),原因是 ;
(2)当X为氯时,若反应①在常温下进行,其离子方程式为 .其中B具有漂白作用,则B的化学式为 .
(3)当X为硫时,若B遇稀硫酸可以产生使品红褪色的气体.则反应②的离子方程式为 ;若反应①中硫过量,则B可以和硫以物质的量之比为1:1发生化合反应生成-种钠盐,该钠盐的化学式为 .

(1)X能否为金属
(2)当X为氯时,若反应①在常温下进行,其离子方程式为
(3)当X为硫时,若B遇稀硫酸可以产生使品红褪色的气体.则反应②的离子方程式为
考点:无机物的推断
专题:推断题
分析:由转化关系图可以看出,A这种单质与强碱发生反应,生成了两种产物B和C,而且B和C均含有同一种元素,且B和C又可以在强酸的作用下发生反应,生成单质A,那么可以看出反应①应该是A物质的歧化反应,反应②应该是关于一种元素的归中反应,则可以知道B和C中应该分别含有A的负价态物质以及正价态物质,由此可以判断A不可能是金属,理由就是金属是不可能含有负价态的,而可逆反应的定义是指在同一条件下,既能向正反应方向进行,同时又能向逆反应的方向进行的反应,叫做可逆反应,显然两个反应的条件不相同.而由上述判断可知,①和②为氧化还原反应(因为归中反应和歧化反应均有价态的变化).
解答:
解:(1)A单质与强碱发生反应,生成了两种产物B和C,而且B和C均含有同一种元素,且B和C又可以在强酸的作用下发生反应,生成单质A,可以看出反应①是A物质的歧化反应,反应②应该是这种元素的归中反应,所以B和C中应该分别含有A的负价态物质以及正价态物质,因为反应①一定属于氧化还原反应,即B、C中X的化合价一定是一个为正价,另一个是负价,而金属是没有负价的,判断A一定是非金属元素,不能为金属元素,
故答案为:不能;因为反应①一定属于氧化还原反应,即B、C中X的化合价一定是一个为正价,另一个是负价,而金属是没有负价的;
(2)当X为氯时,若反应①在常温下进行,反应①为氯气和氢氧化钠的反应,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;其中B具有漂白作用是NaClO水解生成了次氯酸,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;NaClO;
(3)当X为硫时,若B遇稀硫酸可以产生使品红褪色的气体,是B为亚硫酸钠,C为硫化钠,则反应①的离子方程式为3S+6OH-=SO32-+2S2-+3H2O;反应②的离子方程式为:
SO32-+2S2-+6H+=3S+3H2O,若反应①中硫过量,则B可以和硫以物质的量之比为1:1发生化合反应生成-种钠盐,反应为Na2SO3+S=Na2S2O3该钠盐的化学式为Na2S2O3,
故答案为:SO32-+2S2-+6H+=3S+3H2O;Na2S2O3.
故答案为:不能;因为反应①一定属于氧化还原反应,即B、C中X的化合价一定是一个为正价,另一个是负价,而金属是没有负价的;
(2)当X为氯时,若反应①在常温下进行,反应①为氯气和氢氧化钠的反应,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;其中B具有漂白作用是NaClO水解生成了次氯酸,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;NaClO;
(3)当X为硫时,若B遇稀硫酸可以产生使品红褪色的气体,是B为亚硫酸钠,C为硫化钠,则反应①的离子方程式为3S+6OH-=SO32-+2S2-+3H2O;反应②的离子方程式为:
SO32-+2S2-+6H+=3S+3H2O,若反应①中硫过量,则B可以和硫以物质的量之比为1:1发生化合反应生成-种钠盐,反应为Na2SO3+S=Na2S2O3该钠盐的化学式为Na2S2O3,
故答案为:SO32-+2S2-+6H+=3S+3H2O;Na2S2O3.
点评:本题考查了元素化合物的性质推断,主要考查非金属元素的歧化反应和归中反应的特征应用,关键是理解金属无负价,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列离子方程式改写成化学方程式正确的是( )
| A、Cu2++2OH-═Cu(OH)2↓ CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 |
| B、CO32-+2H+═CO2↑+H2O BaCO3+2HCl═BaCl2+CO2↑+H2O |
| C、Ca2++CO32-═CaCO3↓ Ca(NO3)2+BaCO3═CaCO3↓+Ba(NO3)2 |
| D、H++OH-═H2O 2KOH+H2SO4═K2SO4+2H2O |
将氯化铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,则原氯化铝溶液和氢氧化钠溶液的物质的量浓度之比可能是( )
①1:3 ②2:3 ③1:4 ④2:7 ⑤任意比.
①1:3 ②2:3 ③1:4 ④2:7 ⑤任意比.
| A、②③ | B、只有⑤ | C、②④ | D、①④ |
下列各离子浓度的大小比较,正确的是( )
| A、同浓度的下列溶液中:①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4,c(NH4+)由大到小的顺序是:①>③>② |
| B、常温时,将等体积的盐酸和氨水混合后,pH=7,则c(NH4+)>c(Cl-) |
| C、0.2mol?L-1Na2CO2溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| D、0.1 mol?L-1的NH4Cl溶液与0.05mol?L-1NaOH溶液等体积混合:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+) |
用有阳离子交换膜(只允许阳离子通过)的立式隔膜电解槽电解食盐水时,下列叙述错误的是( )
| A、石墨作阳极 |
| B、铁作阴极 |
| C、阴极上水的反应为2H2O+2e-→2OH-+H2↑ |
| D、产品烧碱中混有NaClO杂质 |
 A、B、C、D 是中学化学常见的四种单质,甲、乙、丙为三种化合物,乙在常温下为无色无味的液体,各备物质间转化关系如图(反应条件已略去),请填空:
A、B、C、D 是中学化学常见的四种单质,甲、乙、丙为三种化合物,乙在常温下为无色无味的液体,各备物质间转化关系如图(反应条件已略去),请填空: