题目内容
X、Y、Z、W、T是元素周期表前四周期中的常见元素,其相关信息如下表:
(1)Y在元素周期表中的位置是 ,T基态原子的核外电子排布式为 .
(2)X的电负性比Z (填“大”或“小”),X的一种氢化物X2H2分子中σ和π键的数目比为
(3)Z的最高价氧化物的熔点比干冰高的原因是 ;电解W的饱和钠盐(NaW)溶液的离子方程式为 .
(4)Y的单质在高温下能与T的一种磁性氧化物反应,其化学方程式为 .
(5)已知:①X2(g)+2O2(g)=X2O4(1)△H=-19.5kJ?mol-1
②X2H4(I)+O2(g)=X2(g)+2H2O(g)△H=-534.2kJ?mol-1
则液态X2H4和液态X2O4反应生成气态X2和气态H2O的热化化学方程式为 .
| 元素 | 相关信息 |
| X | 气态氢化物能使湿润的红色石蕊试纸变蓝 |
| Y | 一种核素质量数为27,中子数为14 |
| Z | 单质是良好的半导体材料,广泛应用于光电信息领域 |
| W | 与Y同周期,在该周期主族元素中第一电离能最大 |
| T | 一种氧化物是生产防锈漆的原料 |
(2)X的电负性比Z
(3)Z的最高价氧化物的熔点比干冰高的原因是
(4)Y的单质在高温下能与T的一种磁性氧化物反应,其化学方程式为
(5)已知:①X2(g)+2O2(g)=X2O4(1)△H=-19.5kJ?mol-1
②X2H4(I)+O2(g)=X2(g)+2H2O(g)△H=-534.2kJ?mol-1
则液态X2H4和液态X2O4反应生成气态X2和气态H2O的热化化学方程式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X气态氢化物能使湿润的红色石蕊试纸变蓝,应为氨气,则X为N元素,Y一种核素质量数为27,中子数为14,则质子数为27-14=13,为Al元素,Z单质是良好的半导体材料,广泛应用于光电信息领域,为Si元素,W与Y同周期,在该周期主族元素中第一电离能最大,应为Cl元素,T一种氧化物是生产防锈漆的原料,应为Fe元素,结合对应的单质、化合物的性质以及题目要求解答该题.
解答:
解:X气态氢化物能使湿润的红色石蕊试纸变蓝,应为氨气,则X为N元素,Y一种核素质量数为27,中子数为14,则质子数为27-14=13,为Al元素,Z单质是良好的半导体材料,广泛应用于光电信息领域,为Si元素,W与Y同周期,在该周期主族元素中第一电离能最大,应为Cl元素,T一种氧化物是生产防锈漆的原料,应为Fe元素,
(1)Y为Al,原子序数为13,位于周期表第3周期、ⅢA族,T为Fe,核外电子排布为1s22s22p63s23p63d64s2,
故答案为:第3周期、ⅢA族;1s22s22p63s23p63d64s2;
(2)X为N,Z为Si,电负性N>Si,N的一种氢化物N2H2分子的结构式为H-N=N-H,分子中含有的σ和π键的数目比为3:1,
故答案为:大;3:1;
(3)Si的最高价氧化物为原子晶体,而二氧化碳为分子晶体,则二氧化硅的熔点比干冰高,电解氯化钠溶液,生成氢氧化钠、氢气和氯气,电解方程式为2Cl-+2H2O
2OH-+H2↑+Cl2↑,
故答案为:二氧化硅为原子晶体,二氧化碳为分子晶体;2Cl-+2H2O
2OH-+H2↑+Cl2↑;
(4)铝在高温下与Fe3O4发生置换反应,可用于冶炼铁,方程式为8Al+3Fe3O4
9Fe+4Al2O3,故答案为:8Al+3Fe3O4
9Fe+4Al2O3;
(5)X为N元素,已知:①N2(g)+2O2(g)=N2O4(1)△H=-19.5kJ?mol-1
②N2H4(I)+O2(g)=N2(g)+2H2O(g)△H=-534.2kJ?mol-1,
利用盖斯定律将②×2-①可得得到:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol,
故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol.
(1)Y为Al,原子序数为13,位于周期表第3周期、ⅢA族,T为Fe,核外电子排布为1s22s22p63s23p63d64s2,
故答案为:第3周期、ⅢA族;1s22s22p63s23p63d64s2;
(2)X为N,Z为Si,电负性N>Si,N的一种氢化物N2H2分子的结构式为H-N=N-H,分子中含有的σ和π键的数目比为3:1,
故答案为:大;3:1;
(3)Si的最高价氧化物为原子晶体,而二氧化碳为分子晶体,则二氧化硅的熔点比干冰高,电解氯化钠溶液,生成氢氧化钠、氢气和氯气,电解方程式为2Cl-+2H2O
| ||
故答案为:二氧化硅为原子晶体,二氧化碳为分子晶体;2Cl-+2H2O
| ||
(4)铝在高温下与Fe3O4发生置换反应,可用于冶炼铁,方程式为8Al+3Fe3O4
| ||
| ||
(5)X为N元素,已知:①N2(g)+2O2(g)=N2O4(1)△H=-19.5kJ?mol-1
②N2H4(I)+O2(g)=N2(g)+2H2O(g)△H=-534.2kJ?mol-1,
利用盖斯定律将②×2-①可得得到:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol,
故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol.
点评:本题考查了位置结构与性质的关系,为高频考点,侧重于学生的分析能力的考查,正确判断各元素名称为解答关键,注意掌握原子结构与元素周期表、元素周期律的关系,试题侧重基础知识的考查,有利于培养学生综合应用所学知识的能力,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 常温下,向20mL 0.1moL/L CH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法不正确的是( )
常温下,向20mL 0.1moL/L CH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法不正确的是( )| A、a点表示的溶液中c(OH-)=10-11mol/L | ||
B、a、b点表示的溶液中
| ||
| C、c点表示CH3COOH和NaOH恰好完全反应 | ||
| D、d点表示的溶液中c(Na+)>c(CH3COO-) |
中和滴定是一种操作简单,准确度高的定量分析方法.实际工作中也可利用物质的氧化还原反应、沉淀反应进行类似的滴定分析,这些滴定分析均需要通过指示剂来确定滴定终点,下列对几种具体的滴定分析(待测液置于锥形瓶内)中所用指示剂及滴定终点时的溶液颜色的判断不正确的是( )
| A、用标准的NaOH溶液滴定盐酸溶液以测定其浓度:酚酞试液---浅红色 |
| B、用标准FeCl3溶液滴定KI溶液以测定其浓度:淀粉溶液---蓝色 |
| C、用标准酸性KmnO4溶液滴定Na2SO3溶液以测定其浓度:KmnO4溶液---紫红色 |
| D、利用“Ag++SCN═AgSCN↓”原理,用标准KSCN溶液滴定AgNO3溶液以测定其浓度:FeCl3溶液---红色 |
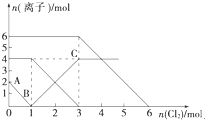 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2=2Fe3++2Br-2Fe3++2I-=2Fe2++I2,则下列有关说法中,不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2=2Fe3++2Br-2Fe3++2I-=2Fe2++I2,则下列有关说法中,不正确的是( )| A、还原性:I->Fe2+>Br- |
| B、原混合溶液中FeBr2的物质的量为3 mol |
| C、当通入2 mol Cl2时,溶液中发生的离子反应可表示为:2Fe2++4I-+3Cl2═2Fe3++2I2+6Cl- |
| D、原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 |
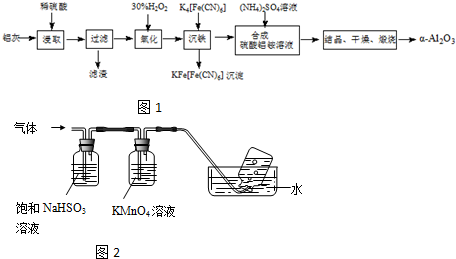
 分析下列两则信息,然后回答有关问题:
分析下列两则信息,然后回答有关问题: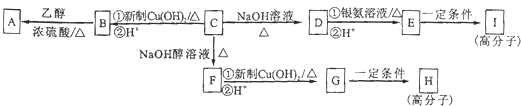
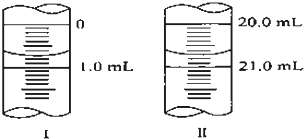 在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:
在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下: