题目内容
X、Y、Z、L、M是元素周期表前四周期中的常见元素,相关信息如下表:请回答下列问题:
(1)X的一种氧化物可用于实验室制O2,其化学反应方程式为 ;
(2)M基态原子价电子排布式为 ;元素Z形成的单质分子中含有的π键与σ键数目之比为 ;
(3)Z、X两元素按原子数目比为1:2和1:3构成分子A和B,则A的结构式为 ;B的电子式为 .
(4)比较Y与L氢化物的稳定性 (用化学式表示);
(5)L的最高价氧化物为无色液体,当0.5mol该物质与一定量的水混合得到一种稀溶液时,放出Q KJ的热量.写出该反应的热化学方程式 .
| 元素 | 相关信息 |
| X | 该元素的一种核素无中子 |
| Y | 单质在氧气中燃烧产物是造成酸雨的罪魁祸首之一 |
| Z | 原子最外层有3个未成对电子,次外层只有一对成对电子 |
| L | 与Y同周期,比Y原子半径小 |
| M | +3价离子3d能级为半充满 |
(2)M基态原子价电子排布式为
(3)Z、X两元素按原子数目比为1:2和1:3构成分子A和B,则A的结构式为
(4)比较Y与L氢化物的稳定性
(5)L的最高价氧化物为无色液体,当0.5mol该物质与一定量的水混合得到一种稀溶液时,放出Q KJ的热量.写出该反应的热化学方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X元素的一种核素无中子,则X为H元素;
Y的单质在氧气中燃烧产物是造成酸雨的罪魁祸首之一,则Y为S元素;
Z原子最外层有3个未成对电子,次外层只有一对成对电子,Z原子只能有2个电子层,核外电子排布为1s22s22p3,则Z为N元素;
L与Y同周期,比Y原子半径小,则L的原子序数大于S、位于第四周期,故L为Cl;
W元素+3价离子3d能级为半充满,离子的核外电子排布为1s22s22p63s23p63d5,故W原子核外电子数=23+3=26,则W为Fe元素,
根据分析可知:X、Y、Z、L、M分别为H、S、N、Cl、Fe,据此进行解答.
Y的单质在氧气中燃烧产物是造成酸雨的罪魁祸首之一,则Y为S元素;
Z原子最外层有3个未成对电子,次外层只有一对成对电子,Z原子只能有2个电子层,核外电子排布为1s22s22p3,则Z为N元素;
L与Y同周期,比Y原子半径小,则L的原子序数大于S、位于第四周期,故L为Cl;
W元素+3价离子3d能级为半充满,离子的核外电子排布为1s22s22p63s23p63d5,故W原子核外电子数=23+3=26,则W为Fe元素,
根据分析可知:X、Y、Z、L、M分别为H、S、N、Cl、Fe,据此进行解答.
解答:
解:X元素的一种核素无中子,则X为H元素;Y的单质在氧气中燃烧产物是造成酸雨的罪魁祸首之一,则Y为S元素;Z原子最外层有3个未成对电子,次外层只有一对成对电子,Z原子只能有2个电子层,核外电子排布为1s22s22p3,则Z为N元素;L与Y同周期,比Y原子半径小,则L的原子序数大于S、位于第四周期,故L为Cl;W元素+3价离子3d能级为半充满,离子的核外电子排布为1s22s22p63s23p63d5,故W原子核外电子数=23+3=26,则W为Fe元素,由信息知:X、Y、Z、L、M分别为H、S、N、Cl、Fe,
(1)X为H,X的一种氧化物可用于实验室制O2,该氧化物为双氧水,双氧水在二氧化锰作催化剂条件下分解生成氧气,反应的化学反应方程式为:2H2O2
2H2O+O2↑,
故答案为:2H2O2
2H2O+O2↑;
(2)M为Fe元素,铁为26号元素,铁元素基态原子电子排布式为:1s22s22p63s23p63d64s2,价电子排布式为:3d64s2;
Z为N元素,其单质为氮气,氮气分子中存在存在氮氮三键,三键中存在2个π键与1gσ键,则氮气分子中含有的π键与σ键数目之比为2:1,
故答案为:3d64s2,2:1;
(3)N、H两元素按原子数目比为1:2和1:3构成分子A和B,则A为N2H4、B为NH3,N2H4分子中N原子之间形成1对共用电子对、H原子与N原子之间形成1对共用电子对,故其结构式为: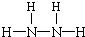 ;
;
NH3分子中N原子与H原子之间各形成1对共用电子对,总共含有3个氮氢键,故其电子式为: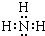 ,
,
故答案为: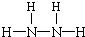 ;
;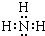 ;
;
(4)Y为S、L为Cl元素,非金属性压强,气态氢化物越稳定,则二者氢化物稳定性大小为:HCl>H2S,
故答案为:HCl>H2S;
(5)L为Cl,L的最高价氧化物为无色液体,该氧化物为Cl2O7,当0.5molCl2O7与一定量的水混合得到高氯酸,放出QKJ的热量,则1mol与水反应生成2mol高氯酸放热的热量为2QkJ,则该反应的热化学方程式为:Cl2O7(1)+H20(l)=2HClO4(aq)△H=-2Q KJ/mol,
故答案为:Cl2O7(l)+H20(l)=2HClO4(aq)△H=-2Q KJ/mol.
(1)X为H,X的一种氧化物可用于实验室制O2,该氧化物为双氧水,双氧水在二氧化锰作催化剂条件下分解生成氧气,反应的化学反应方程式为:2H2O2
| ||
故答案为:2H2O2
| ||
(2)M为Fe元素,铁为26号元素,铁元素基态原子电子排布式为:1s22s22p63s23p63d64s2,价电子排布式为:3d64s2;
Z为N元素,其单质为氮气,氮气分子中存在存在氮氮三键,三键中存在2个π键与1gσ键,则氮气分子中含有的π键与σ键数目之比为2:1,
故答案为:3d64s2,2:1;
(3)N、H两元素按原子数目比为1:2和1:3构成分子A和B,则A为N2H4、B为NH3,N2H4分子中N原子之间形成1对共用电子对、H原子与N原子之间形成1对共用电子对,故其结构式为:
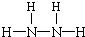 ;
;NH3分子中N原子与H原子之间各形成1对共用电子对,总共含有3个氮氢键,故其电子式为:
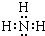 ,
,故答案为:
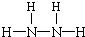 ;
;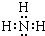 ;
;(4)Y为S、L为Cl元素,非金属性压强,气态氢化物越稳定,则二者氢化物稳定性大小为:HCl>H2S,
故答案为:HCl>H2S;
(5)L为Cl,L的最高价氧化物为无色液体,该氧化物为Cl2O7,当0.5molCl2O7与一定量的水混合得到高氯酸,放出QKJ的热量,则1mol与水反应生成2mol高氯酸放热的热量为2QkJ,则该反应的热化学方程式为:Cl2O7(1)+H20(l)=2HClO4(aq)△H=-2Q KJ/mol,
故答案为:Cl2O7(l)+H20(l)=2HClO4(aq)△H=-2Q KJ/mol.
点评:本题考查结构性质位置关系应用,涉及电子式、晶体类型与性质、热化学方程式、核外电子排布、离子方程式等知识,侧重学生对知识应用考查,题目难度中等,注意掌握原子结构与元素周期表、元素周期律的关系.

练习册系列答案
相关题目
下列各组物质中,前一种是化合物,后一种是混合物的是( )
| A、氧化钙,洁净的雨水 |
| B、氢氧化钾,含铜80%的氧化铜 |
| C、澄清的石灰水,粗盐 |
| D、红磷,空气 |
X、Y、Z、M为4种短周期元素,X、Y位于同周期且原子半径r(X)>r(Y),Y2-与M+的电子层结构相同,X与Z的原子核外最外层电子数相同,Z的单质可制成半导体材料.下列说法不正确的是( )
| A、单质M的晶体是体心立方堆积,M的配位数是8 |
| B、XY2、ZY2、M2Y的晶体分别属于3种不同类型的晶体 |
| C、X的氢化物X2H2分子中含有2个σ键和2个π键 |
| D、由元素X与Z形成的化合物中只含共价键 |