题目内容
中和滴定是一种操作简单,准确度高的定量分析方法.实际工作中也可利用物质的氧化还原反应、沉淀反应进行类似的滴定分析,这些滴定分析均需要通过指示剂来确定滴定终点,下列对几种具体的滴定分析(待测液置于锥形瓶内)中所用指示剂及滴定终点时的溶液颜色的判断不正确的是( )
| A、用标准的NaOH溶液滴定盐酸溶液以测定其浓度:酚酞试液---浅红色 |
| B、用标准FeCl3溶液滴定KI溶液以测定其浓度:淀粉溶液---蓝色 |
| C、用标准酸性KmnO4溶液滴定Na2SO3溶液以测定其浓度:KmnO4溶液---紫红色 |
| D、利用“Ag++SCN═AgSCN↓”原理,用标准KSCN溶液滴定AgNO3溶液以测定其浓度:FeCl3溶液---红色 |
考点:中和滴定
专题:化学实验基本操作
分析:根据滴定的原理以及试剂的颜色判断终点的到达来分析.
A.使用酚酞试液一般都是用碱滴酸,因为溶液由酸性变为弱碱性(酚酞由无色变为粉红色),比由碱性变为弱碱性(酚酞由红色变为粉红色),更为明显;
B.一开始就生成了单质碘,溶液呈蓝色;
C.KMnO4本身就是指示剂,为紫红色;
D.KSCN溶液遇FeCl3溶液呈血红色;
A.使用酚酞试液一般都是用碱滴酸,因为溶液由酸性变为弱碱性(酚酞由无色变为粉红色),比由碱性变为弱碱性(酚酞由红色变为粉红色),更为明显;
B.一开始就生成了单质碘,溶液呈蓝色;
C.KMnO4本身就是指示剂,为紫红色;
D.KSCN溶液遇FeCl3溶液呈血红色;
解答:
解:A、用标准的NaOH溶液滴定盐酸溶液,酚酞为指示剂,溶液由无色变为粉红色为终点的到达,故A正确;
B、利用2Fe3++2I-═I2+2Fe2+原理,由于一开始就生成了单质碘,溶液呈蓝色,无法判断终点,故B错误;
C、用标准酸性KMnO4溶液滴定Na2SO3溶液以测量其浓度,KMnO4本身就是指示剂,溶液由无色变为紫红色为终点的到达,故C正确;
D、利用Ag++SCN-═AgSCN↓原理,可用标准KSCN溶液测量AgNO3溶液浓度,Fe(NO3)3为指示剂,溶液由无色变为血红色为终点的到达,故D正确;
故选B.
B、利用2Fe3++2I-═I2+2Fe2+原理,由于一开始就生成了单质碘,溶液呈蓝色,无法判断终点,故B错误;
C、用标准酸性KMnO4溶液滴定Na2SO3溶液以测量其浓度,KMnO4本身就是指示剂,溶液由无色变为紫红色为终点的到达,故C正确;
D、利用Ag++SCN-═AgSCN↓原理,可用标准KSCN溶液测量AgNO3溶液浓度,Fe(NO3)3为指示剂,溶液由无色变为血红色为终点的到达,故D正确;
故选B.
点评:本题主要考查了指示剂的原理以及终点的现象,抓住实验的原理是解题的关键.

练习册系列答案
相关题目
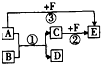 已知 A、B、D是三种常见的有机物,相同条件下,A 的蒸气对于H2的相对密度为 23,A 可以被氧化成 B,E 是密度最小的气体,它们之间有如图所示的转化关系(反应条件及部分产物未标出).下列说法中错误的是( )
已知 A、B、D是三种常见的有机物,相同条件下,A 的蒸气对于H2的相对密度为 23,A 可以被氧化成 B,E 是密度最小的气体,它们之间有如图所示的转化关系(反应条件及部分产物未标出).下列说法中错误的是( )| A、A中的官能团是羟基 |
| B、反应①为取代反应,反应②为置换反应 |
| C、B能与CaCO3反应 |
| D、B与F不反应 |
X、Y、Z、M为4种短周期元素,X、Y位于同周期且原子半径r(X)>r(Y),Y2-与M+的电子层结构相同,X与Z的原子核外最外层电子数相同,Z的单质可制成半导体材料.下列说法不正确的是( )
| A、单质M的晶体是体心立方堆积,M的配位数是8 |
| B、XY2、ZY2、M2Y的晶体分别属于3种不同类型的晶体 |
| C、X的氢化物X2H2分子中含有2个σ键和2个π键 |
| D、由元素X与Z形成的化合物中只含共价键 |
下列有关实验的叙述正确的是( )
| A、只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 |
| B、用萃取分液的方法除去酒精中的水 |
| C、用可见光束照射以区别溶液和胶体 |
| D、根据火焰所呈现的特征焰色,只能检验金属离子的存在 |
中学化学实验室经常用到下列实验装置,其中不可用于物质分离的装置是( )
A、 |
B、 |
C、 |
D、 |
现有一瓶物质是甲和乙的混合物,已知甲和乙的某些性质如下表所示:据此,将甲和乙相互分离的最佳方法是( )
| 物质 | 熔点 | 沸点 | 密度 | 水中溶解性 |
| 甲 | -98℃ | 57.7℃ | 0.93g?cm-3 | 可溶 |
| 乙 | -84℃ | 97℃ | 0.90g?cm-3 | 可溶 |
| A、萃取法 | B、过滤法 |
| C、蒸馏法 | D、分液法 |
下列反应中,反应后固体物质增重的是( )
| A、氢气通过灼热的CuO粉末 |
| B、二氧化碳通过Na2O2粉末 |
| C、将锌粒投入Cu(NO3)2溶液 |
| D、碳酸氢钠固体加热至没有气体放出 |