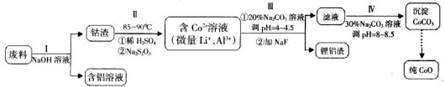
题目内容
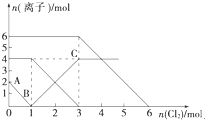 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2=2Fe3++2Br-2Fe3++2I-=2Fe2++I2,则下列有关说法中,不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2=2Fe3++2Br-2Fe3++2I-=2Fe2++I2,则下列有关说法中,不正确的是( )| A、还原性:I->Fe2+>Br- |
| B、原混合溶液中FeBr2的物质的量为3 mol |
| C、当通入2 mol Cl2时,溶液中发生的离子反应可表示为:2Fe2++4I-+3Cl2═2Fe3++2I2+6Cl- |
| D、原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 |
考点:氧化还原反应的计算
专题:
分析:首先根据氧化还原反应中:氧化剂的氧化性>氧化产物的氧化性,还原剂的还原性>还原产物的还原性,氧化剂先氧化还原性强的离子,再氧化还原性弱的离子,判断离子的反应先后顺序,然后根据图象判断参加反应的各离子的物质的量,以此解答该题.
解答:
解:A.反应2Fe2++Br2=2Fe3++2Br-中,还原剂Fe2+的还原性强于还原产物Br-,所以还原性:Fe2+>Br-,反应2Fe3++2I-=2Fe2++I2中,还原剂I-的还原性强于还原产物Fe2+,所以还原性:I->Fe2+,所以还原性I->Fe2+>Br-,故A正确;
B.通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,在通入氯气的量为3~6mol的过程中溴离子从6ml降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol,故B正确;
C.当通入2molCl2时,2mol的I-消耗氯气1mol,余下的1mol氯气再与2molFe2+反应,即溶液中发生的离子反应可表示为2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-,故C错误;
D.由B可知,碘离子的物质的量为2mol,亚铁离子是4mol,溴离子的物质的量是6mol,n(Fe2+):n(I-):n(Br-)=2:1:3,故D正确.
故选C.
B.通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,在通入氯气的量为3~6mol的过程中溴离子从6ml降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol,故B正确;
C.当通入2molCl2时,2mol的I-消耗氯气1mol,余下的1mol氯气再与2molFe2+反应,即溶液中发生的离子反应可表示为2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-,故C错误;
D.由B可知,碘离子的物质的量为2mol,亚铁离子是4mol,溴离子的物质的量是6mol,n(Fe2+):n(I-):n(Br-)=2:1:3,故D正确.
故选C.
点评:本题考查氧化还原反应中氧化性和还原性强弱的知识,综合性较强,题目难度较大,解答本题时注意根据离子的还原性强弱结合图象判断反应的先后顺序和各离子的物质的量,为解答该题的关键,也是易错点,答题时注意体会.

练习册系列答案
相关题目
中学化学实验室经常用到下列实验装置,其中不可用于物质分离的装置是( )
A、 |
B、 |
C、 |
D、 |
现有一瓶物质是甲和乙的混合物,已知甲和乙的某些性质如下表所示:据此,将甲和乙相互分离的最佳方法是( )
| 物质 | 熔点 | 沸点 | 密度 | 水中溶解性 |
| 甲 | -98℃ | 57.7℃ | 0.93g?cm-3 | 可溶 |
| 乙 | -84℃ | 97℃ | 0.90g?cm-3 | 可溶 |
| A、萃取法 | B、过滤法 |
| C、蒸馏法 | D、分液法 |
下列储存药品的方法中,正确的是( )
| A、金属钠保存在水中 |
| B、烧碱溶液保存在玻璃塞试剂瓶中 |
| C、金属钠保存在无水乙醇中 |
| D、浓硝酸可贮存在铝制容器中 |
化学与生产、生活密切相关,下列说法正确的是( )
| A、BaSO4在医学上用做钡餐,是因为Ba2+没有毒 |
| B、FeCl3溶液能与Cu反应,可用于蚀刻印刷电路 |
| C、14C可用于文物的年代鉴定,14C与12C互为同分异构体 |
| D、NO2在光照下能使O2经过复杂的反应生成O3,所以氮氧化物不会破坏臭氧层 |
下列反应中,反应后固体物质增重的是( )
| A、氢气通过灼热的CuO粉末 |
| B、二氧化碳通过Na2O2粉末 |
| C、将锌粒投入Cu(NO3)2溶液 |
| D、碳酸氢钠固体加热至没有气体放出 |
下列化学电池不易造成环境污染的是( )
| A、甲烷燃料电池 | B、锌锰电池 |
| C、镍镉电池 | D、锂电池 |