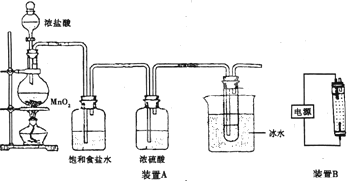
题目内容
下列反应的离子方程式正确的是( )
| A、将过量SO2通入冷的氨水中:SO2+NH3?H2O═HSO3-+NH4+ |
| B、把过量的NaHCO3溶液与Ca(OH)2溶液混合:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| C、硫化钠溶液水解:S2-+2H2O═H2S+2OH- |
| D、硅酸钠溶液与醋酸溶液混合:SiO32-+2H+═H2 SiO3↓ |
考点:离子方程式的书写
专题:离子反应专题
分析:A.过量SO2通入冷的氨水中,反应生成亚硫酸氢铵;
B.过量的NaHCO3溶液与Ca(OH)2溶液混合,反应生成碳酸钠、碳酸钙和水;
C.硫离子水解分步进行,用可逆号;
D.醋酸为弱电解质,保留化学式.
B.过量的NaHCO3溶液与Ca(OH)2溶液混合,反应生成碳酸钠、碳酸钙和水;
C.硫离子水解分步进行,用可逆号;
D.醋酸为弱电解质,保留化学式.
解答:
解:A.将过量SO2通入冷的氨水中,离子方程式:SO2+NH3?H2O═HSO3-+NH4+,故A正确;
B.把过量的NaHCO3溶液与Ca(OH)2溶液混合,离子方程式:2HCO3-+Ca2++2OH-═CaCO3↓+H2O+CO32-,故B错误;
C.硫化钠溶液水解,离子方程式:S2-+H2O HS-+OH-,故C错误;
D.硅酸钠溶液与醋酸溶液混合,离子方程式:SiO32-+2CH3COOH═H2SiO3↓+2CH3COO-,故D错误;
故选:A.
B.把过量的NaHCO3溶液与Ca(OH)2溶液混合,离子方程式:2HCO3-+Ca2++2OH-═CaCO3↓+H2O+CO32-,故B错误;
C.硫化钠溶液水解,离子方程式:S2-+H2O HS-+OH-,故C错误;
D.硅酸钠溶液与醋酸溶液混合,离子方程式:SiO32-+2CH3COOH═H2SiO3↓+2CH3COO-,故D错误;
故选:A.
点评:本题考查了离子方程式的书写,题目难度不大,明确反应的实质、盐类水解的规律是解题关键,注意反应物用量对化学反应的影响,注意化学式的拆分,选项BC为易错选项.

练习册系列答案
相关题目
近几年一种新型的甜味剂--木糖醇悄悄的走进人们的生活,因为木糖醇是一种理想的蔗糖代替品,它具有甜味足、溶解性好、防龋齿、适合糖尿病患者等优点.木糖醇是一种白色粉末状的固体,结构简式为:CH2OH(CHOH)3CH2OH.下列有关木糖醇的叙述错误的是( )
| A、木糖醇与葡萄糖、果糖等一样是一种单糖 |
| B、木糖醇极易溶于水 |
| C、木糖醇是一种五元醇 |
| D、木糖醇是一种无糖型植物甜味剂 |
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )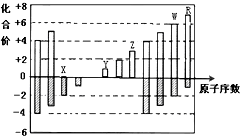

| A、原子半径:Z>Y>X |
| B、气态氢化物的稳定性:W>R |
C、X的一种氢化物具有氧化性,其电子式为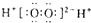 |
| D、Y和Z两者最高价氧化物对应的水化物能相互反应 |
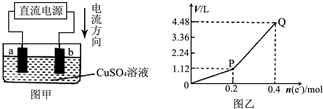 用惰性电极电解一定量的硫酸铜溶液,实验装置如图甲.电解过程中的实验数据如图乙,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).则下列说法不正确的是( )
用惰性电极电解一定量的硫酸铜溶液,实验装置如图甲.电解过程中的实验数据如图乙,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).则下列说法不正确的是( )| A、电解过程中,a电极表面先有红色物质析出,后有气泡产生 |
| B、b电极上发生的反应方程式为:4OH--4e-=2H2O+O2↑ |
| C、曲线0~P段表示O2的体积变化 |
| D、从开始到Q点时收集到的混合气体的平均摩尔质量为12g?mol-1 |
NA表示阿伏加德罗常数值.下列说法正确的是( )
| A、1mol Na2O2与足量CO2充分反应转移的电子数为2NA |
| B、常温下,pH=1的醋酸溶液中,醋酸分子的数目一定大于0.1NA |
| C、向FeI2溶液中通入适量氯气,当有1molFe2+被氧化时,总共转移电子的数目为NA |
| D、t℃时,1L pH=6的纯水中,含1×10-6 NA个OH- |
化学与人类生活、社会可持续发展密切相关,下列措施有利于节能减排、保护环境的是( )
①加快化石燃料的开采与使用;
②研发易降解的生物农药;
③应用高效洁净的能源转换技术;
④田间焚烧秸秆;
⑤酶催化反应具有高效、专一、条件温和等特点,化学模拟生物酶对绿色化学、环境保护及节能减排具有重要意义.
①加快化石燃料的开采与使用;
②研发易降解的生物农药;
③应用高效洁净的能源转换技术;
④田间焚烧秸秆;
⑤酶催化反应具有高效、专一、条件温和等特点,化学模拟生物酶对绿色化学、环境保护及节能减排具有重要意义.
| A、①③⑤ | B、②③⑤ |
| C、①②④ | D、②④⑤ |
下列表示物质结构的化学用语或模型图正确的是( )
A、H2O2的电子式: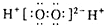 |
| B、结构简式(CH3)2CHOH可以表示1-丙醇,也可以表示2-丙醇 |
| C、二氧化硅的分子式:SiO2 |
| D、质子数为8,中子数为10的氧原子:818O |