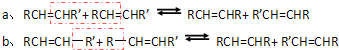题目内容
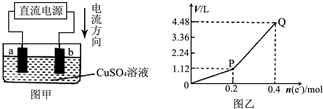 用惰性电极电解一定量的硫酸铜溶液,实验装置如图甲.电解过程中的实验数据如图乙,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).则下列说法不正确的是( )
用惰性电极电解一定量的硫酸铜溶液,实验装置如图甲.电解过程中的实验数据如图乙,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).则下列说法不正确的是( )| A、电解过程中,a电极表面先有红色物质析出,后有气泡产生 |
| B、b电极上发生的反应方程式为:4OH--4e-=2H2O+O2↑ |
| C、曲线0~P段表示O2的体积变化 |
| D、从开始到Q点时收集到的混合气体的平均摩尔质量为12g?mol-1 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:由图可知,电流由正极流向负极,则b为阳极,a为阴极,惰性电极电解一定量的硫酸铜溶液,发生2CuSO4+2H2O
2Cu+O2↑+2H2SO4,结合图2可知,通过0.2mol电子时电解硫酸铜,然后电解硫酸溶液,发生2H2O
2H2↑+O2↑,P到Q点时收集到的混合气体为氢气和氧气,以此来解答.
| ||
| ||
解答:
解:由图可知,电流由正极流向负极,则b为阳极,a为阴极,惰性电极电解一定量的硫酸铜溶液,发生2CuSO4+2H2O
2Cu+O2↑+2H2SO4,结合图2可知,通过0.2mol电子时电解硫酸铜,然后电解硫酸溶液,发生2H2O
2H2↑+O2↑,
A.a为阴极,先发生Cu2++2e-═Cu,后发生2H++2e-═H2↑,a电极表面先有红色物质析出,后有气泡产生,故A正确;
B.b为阳极,溶液中的氢氧根离子放电,则b电极上发生的反应方程式为:4OH--4e-═H2O+O2↑故B正确;
C.由上述分析可知,曲线0~P段表示O2的体积变化,曲线P~Q段表示H2和O2混合气体的体积变化,故C正确;
D.曲线0~P段表示O2的体积变化,P点1.12L为O2,其物质的量为0.05mol,PQ段3.36L气体中,由电解水反应可知0.2mol电子通过时生成0.1mol H2、0.05mol O2,则从开始到Q点收集到的混合气体中O2为0.1mol,H为0.1mol,故混合气体的平均摩尔质量为
=17g?mol-1,故D错误.
故选:D.
| ||
| ||
A.a为阴极,先发生Cu2++2e-═Cu,后发生2H++2e-═H2↑,a电极表面先有红色物质析出,后有气泡产生,故A正确;
B.b为阳极,溶液中的氢氧根离子放电,则b电极上发生的反应方程式为:4OH--4e-═H2O+O2↑故B正确;
C.由上述分析可知,曲线0~P段表示O2的体积变化,曲线P~Q段表示H2和O2混合气体的体积变化,故C正确;
D.曲线0~P段表示O2的体积变化,P点1.12L为O2,其物质的量为0.05mol,PQ段3.36L气体中,由电解水反应可知0.2mol电子通过时生成0.1mol H2、0.05mol O2,则从开始到Q点收集到的混合气体中O2为0.1mol,H为0.1mol,故混合气体的平均摩尔质量为
| 0.1mol×32g/mol+0.1mol×2g/mol |
| 0.1mol+0.1mol |
故选:D.
点评:本题考查电解原理,明确图象这电子转移与生成气体的关系及离子的放电顺序是解答本题的关键,熟悉电解原理即可解答,题目难度不大.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
下列叙述不正确的是( )
| A、纯银器表面在空气中因化学腐蚀渐渐变暗 |
| B、氢氧燃料电池是一种将化学能转化为电能的装置 |
| C、可用浸有酸性高锰酸钾溶液的滤纸来检验二氧化硫气体的漂白性 |
| D、塑料袋在全球“失宠”,有偿使用成为风尚,是因为塑料袋填埋占用土地,且难以降解 |
下列关于电负性的叙述中不正确的是( )
| A、电负性用来描述不同元素的原子对键合电子吸引力的大小 |
| B、电负性是以氟为4.0、锂为1.0作为标准的相对值 |
| C、元素电负性越小,元素非金属性越强 |
| D、元素电负性越大,元素非金属性越强 |
下列第一电离级比较不正确的是( )
| A、F>O | B、O>N |
| C、N>C | D、C>B |
设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A、标准状况下,0.5 mol SO3中含有1.5NA个O原子 |
| B、常温常压下,22 g 14CO2中所含分子数为0.5NA |
| C、室温下,1 L pH=1的H2SO4溶液中含有的H+数目为0.2NA |
| D、7.8g Na2O2与足量水反应,转移电子数为0.2NA |
下列反应的离子方程式正确的是( )
| A、将过量SO2通入冷的氨水中:SO2+NH3?H2O═HSO3-+NH4+ |
| B、把过量的NaHCO3溶液与Ca(OH)2溶液混合:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| C、硫化钠溶液水解:S2-+2H2O═H2S+2OH- |
| D、硅酸钠溶液与醋酸溶液混合:SiO32-+2H+═H2 SiO3↓ |