题目内容
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )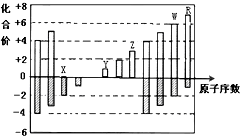

| A、原子半径:Z>Y>X |
| B、气态氢化物的稳定性:W>R |
C、X的一种氢化物具有氧化性,其电子式为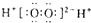 |
| D、Y和Z两者最高价氧化物对应的水化物能相互反应 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:短周期主族元素中,元素最高化合价与其族序数相等,但O、F元素没有最高正化合价,只有最低负极,非金属元素最低负价=族序数-8,根据图片知,X最低负价为-2,则X为O元素;
Y最高正价为+1,且原子序数大于O,为Na元素;
Z最高正价为+3,为Al元素;
W元素最高正价为+6、最低负价为-2,则W为S元素;
R元素最高正价为+7,最低负价为-1,则R为Cl元素,
再结合元素周期律分析解答.
Y最高正价为+1,且原子序数大于O,为Na元素;
Z最高正价为+3,为Al元素;
W元素最高正价为+6、最低负价为-2,则W为S元素;
R元素最高正价为+7,最低负价为-1,则R为Cl元素,
再结合元素周期律分析解答.
解答:
解:短周期主族元素中,元素最高化合价与其族序数相等,但O、F元素没有最高正化合价,只有最低负极,非金属元素最低负价=族序数-8,根据图片知,X最低负价为-2,则X为O元素;
Y最高正价为+1,且原子序数大于O,为Na元素;
Z最高正价为+3,为Al元素;
W元素最高正价为+6、最低负价为-2,则W为S元素;
R元素最高正价为+7,最低负价为-1,则R为Cl元素,
A.原子电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径Y>Z>X,故A错误;
B.非金属性R>W,所以气态氢化物的稳定性R>W,故B错误;
C.X的一种氢化物具有氧化性,为双氧水,双氧水属于共价化合物,其电子式为 ,故C错误;
,故C错误;
D.Y和Z两者最高价氧化物对应的水化物分别为NaOH、Al(OH)3,Al(OH)3能溶于强碱NaOH,故D正确;
故选D.
Y最高正价为+1,且原子序数大于O,为Na元素;
Z最高正价为+3,为Al元素;
W元素最高正价为+6、最低负价为-2,则W为S元素;
R元素最高正价为+7,最低负价为-1,则R为Cl元素,
A.原子电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径Y>Z>X,故A错误;
B.非金属性R>W,所以气态氢化物的稳定性R>W,故B错误;
C.X的一种氢化物具有氧化性,为双氧水,双氧水属于共价化合物,其电子式为
 ,故C错误;
,故C错误;D.Y和Z两者最高价氧化物对应的水化物分别为NaOH、Al(OH)3,Al(OH)3能溶于强碱NaOH,故D正确;
故选D.
点评:本题考查原子结构和元素周期律,明确主族元素化合价与族序数关系是解本题关键,知道元素周期律内涵并灵活运用,注意氢氧化铝的两性,题目难度不大.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案
相关题目
下列各图所示装置,肯定不符合气密性要求的是( )
A、 |
B、 |
C、 |
D、 |
对于如图,下列说法正确的是( )
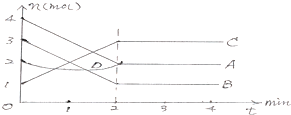

| A、该反应的方程式为:2A+2B?2C+D |
| B、该反应的方程式为:2A+2B=2C 催化剂是D |
| C、该反应是从正反应方向开始的 |
| D、平衡时,V(A)正=V(B)逆=V(C)逆 |
下列叙述不正确的是( )
| A、纯银器表面在空气中因化学腐蚀渐渐变暗 |
| B、氢氧燃料电池是一种将化学能转化为电能的装置 |
| C、可用浸有酸性高锰酸钾溶液的滤纸来检验二氧化硫气体的漂白性 |
| D、塑料袋在全球“失宠”,有偿使用成为风尚,是因为塑料袋填埋占用土地,且难以降解 |
X、Y、Z、W、M五种元素的原子序数依次增大.已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍. M是地壳中含量最高的金属元素.下列说法正确的是( )
| A、五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X |
| B、化合物X2W2、YW2、ZW、ZW2等都含有极性共价键,但都属于非极性分子 |
| C、用M单质作阳极,石墨电极作阴极电解NaHCO3溶液,电解一段时后,在阴极区会出现白色沉淀 |
| D、X、Z两元素能形成原子个数比(X:Z)为3:1和4:2的化合物 |
下列关于电负性的叙述中不正确的是( )
| A、电负性用来描述不同元素的原子对键合电子吸引力的大小 |
| B、电负性是以氟为4.0、锂为1.0作为标准的相对值 |
| C、元素电负性越小,元素非金属性越强 |
| D、元素电负性越大,元素非金属性越强 |
下列第一电离级比较不正确的是( )
| A、F>O | B、O>N |
| C、N>C | D、C>B |
下列反应的离子方程式正确的是( )
| A、将过量SO2通入冷的氨水中:SO2+NH3?H2O═HSO3-+NH4+ |
| B、把过量的NaHCO3溶液与Ca(OH)2溶液混合:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| C、硫化钠溶液水解:S2-+2H2O═H2S+2OH- |
| D、硅酸钠溶液与醋酸溶液混合:SiO32-+2H+═H2 SiO3↓ |
下列与处理方法对应的方程式不正确的是( )
| A、铂做电极,以KOH溶液为电解质溶液的肼--空气燃料电池,放电时的负极反应式:N2H4-4e-+4OH-=N2+4H2O | ||||
B、燃煤中加入生灰石可以减少SO2的排放:O2+2CaO+2SO2
| ||||
| C、用氢氟酸蚀刻玻璃:SiO2+4HF=SiF4↑+2H2O | ||||
| D、将明矾放入浑浊的河水中,可使水澄清:Al3++3H2O=Al(OH)3↓+3H+ |