题目内容
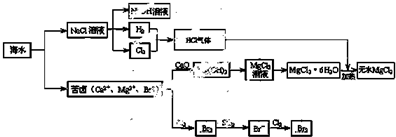
 如图是一种试验氯气化学性质的实验装置,图中B为开关. 如先打开B,再让一种含氯气的气体从A处通入,C中干燥红色布条颜色褪色;当关闭B时,C处红色布条颜色无变化.则D瓶中盛有的溶液是( )
如图是一种试验氯气化学性质的实验装置,图中B为开关. 如先打开B,再让一种含氯气的气体从A处通入,C中干燥红色布条颜色褪色;当关闭B时,C处红色布条颜色无变化.则D瓶中盛有的溶液是( )①浓H2SO4②饱和NaCl溶液 ③浓NaOH溶液 ④饱和碳酸氢钠.
| A、①②③ | B、②③④ |
| C、①②④ | D、①③④ |
考点:氯气的化学性质
专题:卤族元素
分析:先打开B,再让一种含氯气的气体从A处通入,C中干燥红色布条颜色褪色,说明气体中含水蒸气;当关闭B时,C处红色布条颜色无变化,则D瓶中盛有的溶液可吸收氯气或能干燥氯气,以此来解答.
解答:
解:由信息可知,瓶中盛有的溶液可吸收氯气或能干燥氯气,则
①浓H2SO4可干燥氯气,符合题意;
②饱和NaCl溶液不能吸收氯气,也不能干燥氯气,不符合题意;
③浓NaOH溶液与氯气反应,可吸收氯气,符合题意;
④饱和碳酸氢钠与氯气反应,可吸收氯气,符合题意,
故选D.
①浓H2SO4可干燥氯气,符合题意;
②饱和NaCl溶液不能吸收氯气,也不能干燥氯气,不符合题意;
③浓NaOH溶液与氯气反应,可吸收氯气,符合题意;
④饱和碳酸氢钠与氯气反应,可吸收氯气,符合题意,
故选D.
点评:本题考查氯气的性质,为高频考点,把握装置中开关和D的作用为解答的关键,侧重氯气、HClO性质的考查,注重分析与应用能力的考查,注意HClO具有漂白性,题目难度不大.

练习册系列答案
相关题目
随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现. 下列有关说法中,正确的是( )
| A、N5+离子中含有36个电子 |
| B、H2与H3属于同素异形体 |
| C、C60的摩尔质量为720 |
| D、O2与O4属于同位素 |
常温下,下列溶液的pH或微粒的物质的量浓度关系不正确的是( )
| A、在醋酸的稀溶液中存在电离平衡:CH3COOH?CH3COO-+H+,加水一定能使电离平衡右移,氢氧根离子浓度增大 |
| B、pH=2的一元强酸HR溶液与pH=12的NaOH溶液等体积混合后,混合液的pH等于7,则反应后的混合液:c(R- )=c(Na+) |
| C、把pH=2的 HCl和CH3COOH分别加水稀释相同倍数后,CH3COOH的pH比HCl的小 |
| D、某物质的溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,则该溶液的pH一定为14-a |
下列关于化学反应方向的叙述中正确的是( )
| A、△H<0,△S>0的反应肯定是自发的 |
| B、△H<0,△S<0的反应肯定是自发的 |
| C、△H>0,△S>0的反应肯定是自发的 |
| D、△H>0,△S<0的反应肯定是自发的 |
下列物质在水中的电离方程式中正确的是( )
A、NaHSO4═Na++HSO
| ||
| B、AlCl3═Al+3+3Cl- | ||
| C、KClO3═K++Cl-+3O2- | ||
D、Al2(SO4)3═2Al3++3SO
|
从海水中提取部分物质的过程如图所示
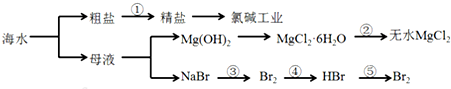
下列有关说法不正确的是( )

下列有关说法不正确的是( )
| A、从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能的过程 |
| B、过程②中结晶出的MgCl2?6H2O要在HCl氛围中加热脱水制得无水MgCl2 |
| C、经过③④实现了溴元素的富集 |
| D、电解MgCl2溶液制取Mg单质 |
下列叙述或表示正确的是( )
| A、常温下pH均为3的醋酸和硫酸的水溶液,分别加水稀释100倍后,两种溶液的pH仍相同 |
| B、氢氧化钙溶液中加入过量的碳酸氢钙溶液的离子方程式:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| C、Ksp反映了难熔电解质在水中的溶解能力,它的大小与浓度无关,与温度无关 |
| D、c(H+)=1×10-2 mol?L的溶液:Fe2+、Ba2+、N03-、Cl-能大量共存 |
用H2还原xgCuO,当大部分固体变红时停止加热,冷却后得残留固体yg,共用掉z g H2,此时生成水的质量为( )
A、
| ||
B、
| ||
| C、9 z g | ||
D、
|