题目内容
如图是海水化学资源综合利用的部分流程图: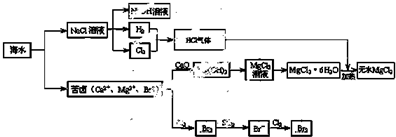
(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,若要除去这些离子,需要依次加入稍过量的NaOH、BaCl2、 (填试剂化学式), (填操作名称),再加入适量 (填试剂名称).将所得溶液加热浓缩、冷却结晶,得到精盐.
(2)制取MgCl2的过程中涉及反应:MgCl2?6H2O
MgCl2+6H2O,该反应要在HCl气流中进行,原因是 .
(3)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收转化为Br-,反复多次,以达到富集溴的目的.由海水提溴过程中的反应可得出Cl-、SO2、Br-还原性由强到弱的顺序是 .
(4)工业上也可以用Na2CO3溶液吸收吹出的Br2,生成物有溴化钠和溴酸钠及无色气体放出.对应的化学方程式是 .

(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,若要除去这些离子,需要依次加入稍过量的NaOH、BaCl2、
(2)制取MgCl2的过程中涉及反应:MgCl2?6H2O
| ||
(3)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收转化为Br-,反复多次,以达到富集溴的目的.由海水提溴过程中的反应可得出Cl-、SO2、Br-还原性由强到弱的顺序是
(4)工业上也可以用Na2CO3溶液吸收吹出的Br2,生成物有溴化钠和溴酸钠及无色气体放出.对应的化学方程式是
考点:海水资源及其综合利用
专题:实验设计题
分析:(1)用氢氧化钠溶液除去镁离子、用氯化钡溶液除去硫酸根离子、用碳酸钠溶液除去钙离子;分离不溶性固体和溶液采用过滤的方法;在溶液中加入少量稀盐酸除去杂质;
(2)氯化镁晶体在加热过程中易水解生成氢氧化镁和HCl;
(3)在自发进行的氧化还原反应中,还原剂的还原性大于还原产物的还原性;
(4)根据反应物、生成物,利用化合价升降总数相等和质量守恒来配平.
(2)氯化镁晶体在加热过程中易水解生成氢氧化镁和HCl;
(3)在自发进行的氧化还原反应中,还原剂的还原性大于还原产物的还原性;
(4)根据反应物、生成物,利用化合价升降总数相等和质量守恒来配平.
解答:
解:(1)用氢氧化钠溶液除去镁离子、用氯化钡溶液除去硫酸根离子,碳酸根离子和钙离子反应生成碳酸钙沉淀,所以用碳酸钠溶液除去钙离子;分离不溶性固体和溶液采用过滤的方法,所以该操作名称是过滤;
在溶液中加入少量稀盐酸除去碳酸钠,盐酸具有挥发性,利用HCl的挥发性除去稀盐酸,
故答案为:Na2CO3;过滤;稀盐酸;
(2)氯化镁晶体在加热过程中易水解生成氢氧化镁和HCl,为防止氯化镁水解,应该在HCl气流中加热氯化镁晶体;
故答案为:氯化镁易水解,MgCl2+2H2O?Mg(OH)2+2HCl,在HCl气流中,可以抑制MgCl2水解,同时带走水分;
(3)在自发进行的氧化还原反应中,还原剂的还原性大于还原产物的还原性,Cl2+2 Br-=Br2+2Cl-中还原性为Br->Cl-,SO2+2H2O+Br2=H2SO4+2HBr中还原性为SO2>Br-,所以还原性强弱顺序是 SO2>Br->Cl-;
故答案为:SO2>Br->Cl-;
(4)工业上也可以用Na2CO3溶液吸收吹出的Br2,生成物有溴化钠和溴酸钠及无色气体放出,生成一个NaBr化合价降低1,生成一个NaBrO3化合价升高5,根据化合价升降总数相等和质量守恒来配平得:3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑,
故答案为:3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑.
在溶液中加入少量稀盐酸除去碳酸钠,盐酸具有挥发性,利用HCl的挥发性除去稀盐酸,
故答案为:Na2CO3;过滤;稀盐酸;
(2)氯化镁晶体在加热过程中易水解生成氢氧化镁和HCl,为防止氯化镁水解,应该在HCl气流中加热氯化镁晶体;
故答案为:氯化镁易水解,MgCl2+2H2O?Mg(OH)2+2HCl,在HCl气流中,可以抑制MgCl2水解,同时带走水分;
(3)在自发进行的氧化还原反应中,还原剂的还原性大于还原产物的还原性,Cl2+2 Br-=Br2+2Cl-中还原性为Br->Cl-,SO2+2H2O+Br2=H2SO4+2HBr中还原性为SO2>Br-,所以还原性强弱顺序是 SO2>Br->Cl-;
故答案为:SO2>Br->Cl-;
(4)工业上也可以用Na2CO3溶液吸收吹出的Br2,生成物有溴化钠和溴酸钠及无色气体放出,生成一个NaBr化合价降低1,生成一个NaBrO3化合价升高5,根据化合价升降总数相等和质量守恒来配平得:3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑,
故答案为:3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑.
点评:本题考查了海水资源的综合利用,涉及还原性强弱比较、除杂剂的选取、氯化镁的制取、氧化还原反应等知识点,根据还原性强弱比较方法、物质的性质等知识点来分析解答,题目难度中等.

练习册系列答案
相关题目
 如图是一种试验氯气化学性质的实验装置,图中B为开关. 如先打开B,再让一种含氯气的气体从A处通入,C中干燥红色布条颜色褪色;当关闭B时,C处红色布条颜色无变化.则D瓶中盛有的溶液是( )
如图是一种试验氯气化学性质的实验装置,图中B为开关. 如先打开B,再让一种含氯气的气体从A处通入,C中干燥红色布条颜色褪色;当关闭B时,C处红色布条颜色无变化.则D瓶中盛有的溶液是( )