题目内容
7.高铁酸钾(K2FeO4)是一种既能杀菌、消毒,又能絮凝净水的水处理剂.工业制备高铁酸钾的离子方程式为Fe(OH)3+ClO-+OH-→FeO42-+Cl-+H2O(未配平),下列有关说法不正确的是( )| A. | 由上述反应可知,Fe(OH)3的氧化性强于FeO42- | |
| B. | 高铁酸钾中铁显+6价 | |
| C. | 上述反应中氧化剂和还原剂的物质的量之比为3:2 | |
| D. | K2FeO4处理水时,不仅能消毒杀菌,而且生成的Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质 |
分析 A.氧化剂的氧化性强于氧化产物的氧化性;
B.离子中各元素化合价代数和等于离子所带电荷;
C.反应中Fe(OH)3是还原剂,C1O-是还原剂,根据电子转移守恒计算二者物质的量之比;
D.K2FeO4中铁为高价铁,具有强氧化性能杀菌,Fe(OH)3(胶体)具有净水作用.
解答 解:A.反应Fe(OH)3+C1O-+OH-→FeO42-+C1-+H2O中,氯元素化合价降低,C1O-是氧化剂,铁元素化合价升高,Fe(OH)3是还原剂,FeO42-是氧化产物,氧化性C1O->FeO42-,实际氧化性FeO42->Fe(OH)3,故A错误;
B.令FeO42-中,铁元素的化合价为x,则x+4×(-2)=-2,解得x=+6,故B正确;
C.反应Fe(OH)3+C1O-+OH-→FeO42-+C1-+H2O中,氯元素化合价由+1降低为-1价,C1O-是氧化剂,铁元素化合价由+3价升高为+6价,Fe(OH)3是还原剂,所以反应中氧化剂和还原剂的物质的量之比为(6-3):2=3:2,故C正确;
D.K2FeO4具有氧化性所以能杀菌,高铁酸钾被还原为Fe3+,Fe3+水解生成的Fe(OH)3(胶体)具有净水作用,故D正确.
故选A.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应基本概念及应用,题目难度不大.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
17.根据有机化合物的命名原则,下列命名错误的是( )
| A. | 2,3-二甲基-4-乙基己烷 | B. |  1,2-二甲苯 1,2-二甲苯 | ||
| C. |  甲酸苯酚酯 甲酸苯酚酯 | D. |  苯甲酸甲酯 苯甲酸甲酯 |
15.某溶液中存在大量的Cl-、SO42-、H+.该溶液中还可能大量存在的离子是( )
| A. | OH- | B. | Ba2+ | C. | Na+ | D. | Ag+ |
2.下列各组物质的稀溶液,不用其他的试剂只根据相互滴加的方法,不能鉴别的是( )
| A. | AlCl3 和NaOH | B. | NaAlO2和HCl | C. | Na2CO3和HCl | D. | NaHCO3和Ca(OH)2 |
12.下列有关化学用语的表示正确的是( )
| A. | N2的电子式: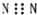 | |
| B. | 甲烷分子的比例模型是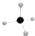 | |
| C. | 硝基和二氧化氮两种粒子所含电子数相等 | |
| D. | 中子数为10的氧原子:${\;}_{8}^{10}$O |
16.化学与生产、生活密切相关.下列叙述不正确的是( )
| A. | 晶体硅制作的光导纤维遇强碱会“断路” | |
| B. | 煤的综合利用主要是通过煤的干馏、液化和气化以获得洁净的燃料和多种化工原料 | |
| C. | 氢气燃烧能放出大量的热量,燃烧产物是水,所以是理想的清洁燃料 | |
| D. | 化学电源有一次电池和二次电池之分,一次电池用过之后不能复原 |
17.关于化学能与热能的叙述,正确的是( )
| A. | 酸与碱恰好中和时所放出的热量叫中和热 | |
| B. | 化学反应中能量变化的大小与反应物的质量无关 | |
| C. | 伴有能量变化的过程都是化学变化 | |
| D. | 化学反应中的能量变化,主要是由化学键变化引起的 |

 ,写出Cl在周期表中的位置第三周期VIIA族.
,写出Cl在周期表中的位置第三周期VIIA族.