题目内容
10.下列说法正确的是( )| A. | 发酵粉的主要成分为碳酸钠 | |
| B. | 在饱和的碳酸钠溶液中通入二氧化碳,会产生沉淀 | |
| C. | 与盐酸反应的激烈程度:碳酸钠大于碳酸氢钠 | |
| D. | 等质量的碳酸钠和碳酸氢钠与足量的盐酸反应,碳酸钠产生的氢气多 |
分析 A.发酵粉的主要成分为碳酸氢钠;
B.碳酸钠和二氧化碳反应生成溶解度更小的碳酸氢钠;
C.碳酸钠和盐酸反应时,先生成碳酸氢钠,然后碳酸氢钠再和盐酸反应生成氯化钠、水和二氧化碳;
D.利用n=$\frac{m}{M}$,可计算物质的量,因酸足量,利用Na2CO3~CO2,NaHCO3~CO2来分析;
解答 解:A.发酵粉的主要成分为碳酸氢钠,俗称为小苏打,故A错误;
B.碳酸钠和二氧化碳反应生成碳酸氢钠,Na2CO3+CO2+H2O=2NaHCO3↓,由于碳酸氢钠的溶解度比碳酸钠小,生成的碳酸氢钠析出晶体,则溶液变浑浊产生沉淀,故B正确;
C.碳酸钠和盐酸反应时,先转化为碳酸氢钠,碳酸氢钠再与盐酸反应生成二氧化碳,故相同条件下,与酸反应的速率碳酸钠<碳酸氢钠,故C错误;
D.设质量都是106g,则Na2CO3和NaHCO3的物质的量分别为1mol、$\frac{106}{84}$mol,根据Na2CO3~CO2,NaHCO3~CO2,产生的CO2的物质的量分别为1mol、$\frac{106}{84}$mol,碳酸氢钠产生的二氧化碳气体多,故D错误;
故选B.
点评 本题考查Na2CO3和NaHCO3性质的异同,题目难度不大,注意把握Na2CO3和NaHCO3性质,注重基础知识的积累.

练习册系列答案
相关题目
20.在相同温度下,等体积等物质的量浓度的4种稀溶液:①Na2SO4、②H2SO4、③NaHSO4、④Na2S中所含离子种类由多到少的顺序是( )
| A. | ①=④>③=② | B. | ④=①>③>② | C. | ①>④>③>② | D. | ④>①=③>② |
5.进入化学实验必须注意安全,下列实验操作或事故处理正确的是( )
| A. | 具有腐蚀性的药品必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量 | |
| B. | 使用容量瓶前,在容量瓶中加适量水,用食指摁住瓶塞倒立,如不漏水,即可使用 | |
| C. | 混合浓硫酸和乙醇时,将浓硫酸慢慢加入乙醇试管中并及时搅拌 | |
| D. | 油或酒精着火时都可以用水扑灭 |
15.某溶液中存在大量的Cl-、SO42-、H+.该溶液中还可能大量存在的离子是( )
| A. | OH- | B. | Ba2+ | C. | Na+ | D. | Ag+ |
2.下列各组物质的稀溶液,不用其他的试剂只根据相互滴加的方法,不能鉴别的是( )
| A. | AlCl3 和NaOH | B. | NaAlO2和HCl | C. | Na2CO3和HCl | D. | NaHCO3和Ca(OH)2 |
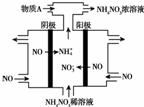 NH4NO3主要用作肥料、军用炸药、冷冻剂、制造笑气等.
NH4NO3主要用作肥料、军用炸药、冷冻剂、制造笑气等.
 ,写出Cl在周期表中的位置第三周期VIIA族.
,写出Cl在周期表中的位置第三周期VIIA族.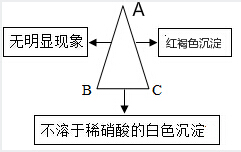 现有A、B、C三种物质,已知A是一种氯化物,B是一种钠盐,C是一种碱,下图表示的是A、B、C的溶液两两混合的实验现象.请回答下列个小题:
现有A、B、C三种物质,已知A是一种氯化物,B是一种钠盐,C是一种碱,下图表示的是A、B、C的溶液两两混合的实验现象.请回答下列个小题: