题目内容
5.短周期元素X、Y、M、N的原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10.X与M同主族,Y与N同主族,X、M原子的最外层电子数之和等于Y原子的次外层电子数.则下列叙述正确的是( )| A. | 在Y、N的最高价氧化物中,Y、N与氧原子之间均为双键 | |
| B. | 一定条件下,Y单质能置换出N单质,M能置换出X单质 | |
| C. | N元素位于元素周期表中第3周期I V族 | |
| D. | 四种元素的原子半径:X<Y<M<N |
分析 短周期元素X、Y、M、N的原子序数依次递增,X与M同主族,X、M原子的最外层电子数之和等于Y原子的次外层电子数,
若Y的次外层为2,则X为H、M为Na,原子最外层电子数之和为10,则Y为C元素,N为Si元素,它们的核电荷数之和为32,符合题意;
若Y的次外层为8,则X为C、M为Si,原子最外层电子数之和为10,则Y与N的最外层电子数为1,可能为H、Li、Na,但是N的原子序数大于Si,不符合题意;
综上可知,X为H、Y为C、M为Na、N为Si,据此结合元素化合物的性质和元素周期律解答.
解答 解:短周期元素X、Y、M、N的原子序数依次递增,X与M同主族,X、M原子的最外层电子数之和等于Y原子的次外层电子数,
若Y的次外层为2,则X为H、M为Na,原子最外层电子数之和为10,则Y为C元素,N为Si元素,它们的核电荷数之和为32,符合题意;
若Y的次外层为8,则X为C、M为Si,原子最外层电子数之和为10,则Y与N的最外层电子数为1,可能为H、Li、Na,但是N的原子序数大于Si,不符合题意;
综上可知,X为H、Y为C、M为Na、N为Si,
A.Si与哦的化合物为SiO2,只存在Si-O单键,没有双键,故A错误;
B.一定条件下,C单质能置换出硅单质,Na能置换出氢气,故B正确;
C.Si元素位于元素周期表中第3周期IVA族,故C错误;
D.同主族元素从上到下原子半径逐渐增大,同周期元素从左到右原子半径逐渐减小,则原子半径Na>Si>C>H,故D错误.
故选B.
点评 本题考查原子结构与元素周期律的关系,注意根据原子结构特点判断元素的种类为解答该题的关键,把握元素周期律的递变规律,题目难度不大,本题注意晶体类型的区别.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列有关酶的说法错误的是( )
| A. | 酶是具有催化作用的蛋白质 | |
| B. | 酶的催化作用具有选择性和专一性 | |
| C. | 高温或重金属盐能使酶失去生理活性 | |
| D. | 酶只有在强酸性或强碱性条件下才能发挥作用 |
13.已知:在25℃时,H2O?H++OH- KW=10-14
CH3COOH?H++CH3COO- Ka=1.8×10-5
KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、KSP[Cd(OH)2]=2.5×10-14
又已知:$\sqrt{5}$=2.2
下列说法正确的是( )
CH3COOH?H++CH3COO- Ka=1.8×10-5
KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、KSP[Cd(OH)2]=2.5×10-14
又已知:$\sqrt{5}$=2.2
下列说法正确的是( )
| A. | 醋酸钠水解的平衡常数Kh随温度升高而减小 | |
| B. | 0.5mol•L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol•L-1醋酸钠溶液pH为n,水解的程度为b,则m<n、a>b | |
| C. | 醋酸钠的水解的平衡常数Kh=KW•Ka | |
| D. | 在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为0.01mol•L-1,向其中加入固体醋酸钠,使其浓度为0.9mol•L-1,以上三种金属离子中只有Zn2+能生成沉淀 |
20.在NaClO和NaCl混合溶液中能大量共存的离子组是( )
| A. | H+、Al3+、NH4+、SO42- | B. | Ag+、NO3-、Na+、Ba2+ | ||
| C. | Fe2+、NO3-、SO42-、Na+ | D. | K+、CO32-、SO42-、OH- |
10.对如图甲、乙两种化合物的结构或性质描述正确的是( )


| A. | 甲和乙互为同分异构体,均既能发生氧化反应,又能发生酯化反应 | |
| B. | 分子中共平面的碳原子数相同 | |
| C. | 可用红外光谱区分,但不能用核磁共振氢谱区分 | |
| D. | 均能与溴水反应 |
14.对原子核外电子以及电子的运动,下列描述正确的是( )
①可以测定某一时刻电子在原子中所处的位置
②电子质量很小且带负电荷
③电子在原子里有“广阔”的运动空间
④运动速度接近光速
⑤与宏观物体一样有固定的运动轨道
⑥现代最先进的扫描隧道显微镜也观察不到电子的运动.
①可以测定某一时刻电子在原子中所处的位置
②电子质量很小且带负电荷
③电子在原子里有“广阔”的运动空间
④运动速度接近光速
⑤与宏观物体一样有固定的运动轨道
⑥现代最先进的扫描隧道显微镜也观察不到电子的运动.
| A. | ①②③⑥ | B. | ②③④⑥ | C. | ③④⑤⑥ | D. | ⑤⑥ |
15.晶体是一类非常重要的材料,在很多领域都有广泛的应用.我国现已能够拉制出直径为300毫米,重量达81千克的大直径硅单晶,晶体硅大量用于电子产业.下列对晶体硅的叙述正确的是( )
| A. | 晶体硅没有固定的熔沸点 | |
| B. | 形成晶体硅的速率越快越好 | |
| C. | 可用于X-射线衍射实验来鉴别晶体硅和玻璃 | |
| D. | 晶体硅的形成与晶体的自范性有关,形成的晶体无各向异性 |
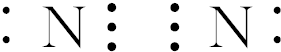 ,
, ,
, .
.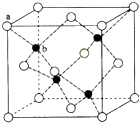 CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分.
CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分.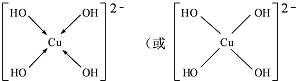 ;
;