题目内容
17. CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分.
CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分.(1)Cu2+基态的电子排布式可表示为1s22s22p63s23p63d9(或[Ar]3d9);
(2)SO42-的空间构型为正四面体(用文字描述);中心原子采用的轨道杂化方式是sp3;写出一种与SO42-互为等电子体的分子的化学式:CCl4或SiCl4;
(3)向CuSO4 溶液中加入过量NaOH溶液可生成[Cu (OH)4]2-.不考虑空间构型,
[Cu(OH)4]2-的结构可用示意图表示为
 ;
;(4)资料显示ZnS为难溶物,在活化过程中,CuSO4能转化为CuS的原因是在相同温度下,Ksp(CuS)<Ksp(ZnS),或相同温度下,CuS比ZnS更难溶.
(5)CuS比CuO的熔点低(填高或低),原因是CuO晶格能比CuS大.
(6)闪锌矿的主要成分ZnS,晶体结构如图所示,其晶胞边长为540.0pm,密度为$\frac{\frac{4×(65+32)g/mol\\;}{6.02×1{0}^{23}mo{l}^{-1}}}{(540×1{0}^{-10}cm)^{3}}$=4.1g/(cm)3(列式并计算),a位置S2-离子与b位置Zn2+离化学-选修5:有机化学基础子之间的距离为$\frac{270}{\sqrt{1-cos109°28′}}$pm(列式表示).
分析 (1)根据元素符号,判断元素原子的核外电子数,再根据核外电子排布规律来写;
(2)计算S原子的价电子对数进行判断;具有相同原子数和价电子数的微粒互称为等电子体;
(3)[Cu(OH)4]2-中与Cu2+与4个OH-形成配位键;
(4)根据沉淀转化原理分析;
(5)离子晶体中离子半径越小,离子所带电荷越多,离子键越强,晶格能越大,熔点越高;
(6)利用均摊法计算晶胞中含有的硫原子和锌原子,根据ρ=$\frac{\frac{M}{{N}_{A}}}{V}$计算密度;每个黑色小球连接4个白色小球,构成正四面体结构,白球和黑球之间的夹角为109°28′,两个白球之间的距离=270$\sqrt{2}$pm,根据余弦定理计算白球和黑球之间的距离.
解答 解:(1)Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1,Cu2+基态的电子排布式可表示为1s22s22p63s23p63d9,
故答案为:1s22s22p63s23p63d9;
(2)SO42-的价电子对数=$\frac{6+2}{2}$=4,形成四条杂化轨道,S原子的杂化方式为sp3,形成四面体结构,价电子对数=孤电子对数+配位原子数,可知孤电子对数为0,所以为正四面体结构;具有相同原子数和价电子数的微粒互称为等电子体,所以与SO42-互为等电子体的微粒有SiCl4等;
故答案为:正四面体;sp3;SiCl4;
(3))[Cu(OH)4]2-中与Cu2+与4个OH-形成配位键,可表示为 ,
,
故答案为: ;
;
(4)由沉淀转化原理可知溶度积大的沉淀转化为溶度积小的沉淀容易实现,在相同温度下,Ksp(CuS)<Ksp(ZnS),所以ZnS能转化为CuS;
故答案为:在相同温度下,Ksp(CuS)<Ksp(ZnS);
(5)离子晶体中离子半径越小,离子所带电荷越多,离子键越强,晶格能越大,熔点越高,CuS与CuO中O2-比S2-半径小,所以CuO的熔点比CuS高;
故答案为:低;CuO晶格能比CuS大;
(6)黑球全部在晶胞内部,该晶胞中含有黑球个数是4,白球个数=$\frac{1}{8}$×8+$\frac{1}{2}$×6=4,ρ=$\frac{\frac{M}{{N}_{A}}}{V}$=$\frac{\frac{4×(65+32)g/mol\\;}{6.02×1{0}^{23}mo{l}^{-1}}}{(540×1{0}^{-10}cm)^{3}}$=4.1g/(cm)3,
每个黑色小球连接4个白色小球,构成正四面体结构,白球和黑球之间的夹角为109°28′,两个白球之间的距离=270$\sqrt{2}$pm,设S2-离子与Zn2+离子之间的距离为x,2x2-2x2cos109°28′=(270$\sqrt{2}$)2,x=$\frac{270}{\sqrt{1-cos109°28′}}$pm;
故答案为:4.1g/(cm)3;$\frac{270}{\sqrt{1-cos109°28′}}$.
点评 本题考查了核外电子的排布、分子的空间构型、配位键、晶胞的计算等知识点,难度较大,会利用均摊法计算晶胞中含有的离子,注意运用余弦定理计算硫离子和锌离子之间的距离,为难点.

①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率之比为2:2:1
④混合气体的颜色不再改变
⑤混合气体的密度不再改变
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态.
| A. | ①④⑥⑦ | B. | ②⑤⑥⑦ | C. | ①③④⑤ | D. | 全部 |
| A. | 在Y、N的最高价氧化物中,Y、N与氧原子之间均为双键 | |
| B. | 一定条件下,Y单质能置换出N单质,M能置换出X单质 | |
| C. | N元素位于元素周期表中第3周期I V族 | |
| D. | 四种元素的原子半径:X<Y<M<N |
| A. | 1:1 | B. | 1:2 | C. | 2:3 | D. | 5:6 |
| A. | CH3CH(OH)CH3 | B. | CH3CH2CH2CH2OH | C. | CH3CH2CH2OH | D. | CH3CH2OCH2CH3 |
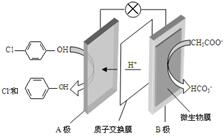 现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚,其原理如图所示,下列说法正确的是( )
现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚,其原理如图所示,下列说法正确的是( )| A. | 电流方向从B极沿导线经小灯泡流向A极 | |
| B. | A极的电极反应式为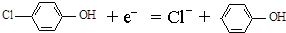 | |
| C. | 当外电路中有0.2mole-转移时,通过质子交换膜的H+的个数为0.2NA | |
| D. | B极为电池的正极,发生还原反应 |
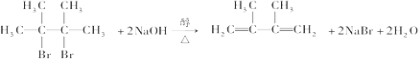 ;
;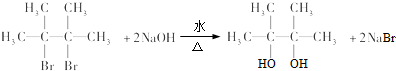 ;E与乙二醇的关系是同系物.
;E与乙二醇的关系是同系物. .
. 氨气在工农业生产中有非常重要的应用.
氨气在工农业生产中有非常重要的应用.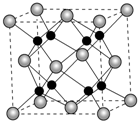 A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题: